王德平博士在《Particle and Fibre Toxicology》发文:首次报道二氧化硅纳米粒子(SiNPs)对内皮细胞的损伤机制
我校细胞生理学教育部重点实验室曹济民团队青年教师王德平博士最新的研究成果题为《Silica nanomaterials induce organ injuries by Ca2+-ROS-initiated disruption of the endothelial barrier and triggering intravascular coagulation》(二氧化硅纳米材料通过Ca2+- ROS触发内皮屏障破坏并触发血管内凝血诱导器官损伤)的科研论文发表在Top 1区期刊《Particle and Fibre Toxicology》(影响因子:7.546)。青年教师王昭君作为本文的共同第一作者,在研究中有重要贡献。
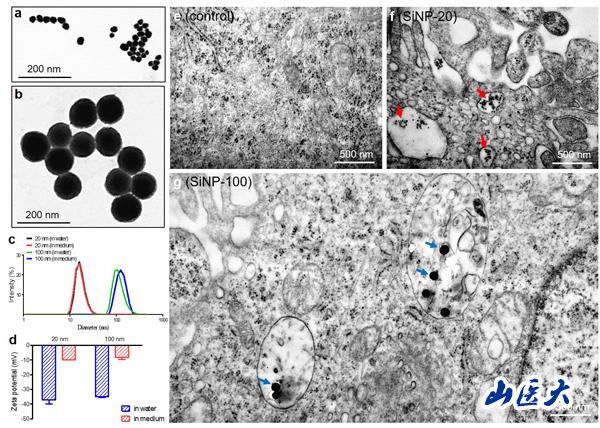
(电镜下二氧化硅纳米颗粒SiNPs形态及内吞作用)
该研究首次报道了二氧化硅纳米粒子(SiNPs)在分子、细胞和整体水平对内皮细胞的毒性作用及其损伤机制。该研究针对颗粒直径为20 nm和100 nm的SiNPs可能造成的不同毒性作用,在体外培养的人脐静脉内皮细胞(HUVECs)和成年雌性Balb/c小鼠中进行研究。
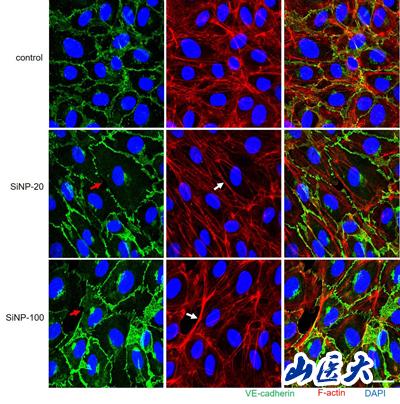
(SiNPs对HUVEC细胞连接完整性的影响)
在细胞实验中,发现SiNP-20和SiNP-100均使HUVECs细胞活力降低,细胞膜受损,并以浓度依赖性的方式抑制HUVECs的迁移和管的形成。两种SiNPs均可诱导显著的钙动员和活性氧(ROS)的产生,增加血管内皮(VE)-cadherin在酪氨酸731残基位点(pY731-VEC)的磷酸化,降低VE-cadherin的表达,破坏VE-cadherin的连续性并诱导F-actin在HUVECs中的重新组装。通过YM58483阻断Ca2+释放激活Ca2+(CRAC)通道或n -乙酰半胱氨酸(NAC)消除ROS,可逆转对内皮细胞的损伤。
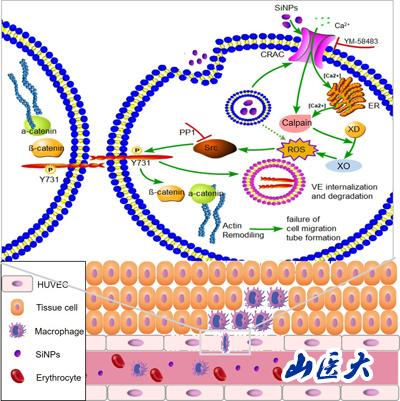
(本研究提出导致SiNPs诱导内皮屏障损伤的信号通路示意图)
在体实验中,静脉注射SiNP-20和SiNP-100均以剂量、颗粒大小和暴露时间依赖的方式诱导Balb/c小鼠多器官的损伤。在SiNPs暴露后,可引起小鼠的多器官损伤,包括内皮损伤、血管内凝血和继发性炎症。在体内多器官组织中,SiNPs降低了VE-cadherin的表达,改变了VE-cadherin的空间分布。
由此说明SiNPs暴露导致的损伤可能是由上游Ca2+-ROS信号通路和下游VE-cadherin磷酸化破坏以及F-actin重构所引起。基于本研究的发现将有助于更好地理解SiNPs的生物毒性,并开发相关的转化途径。
