细胞生理学教育部重点实验室曹济民教授团队在国际著名期《Cell & Bioscience》发文:首次解析伊列乌斯病毒解旋酶的晶体结构,为加深黄病毒生物学的理解及抗病毒药物的开发提供了重要信息
我校细胞生理学教育部重点实验室曹济民教授团队的最新研究成果《Crystal structure of the Ilheus virus helicase: implications for enzyme function and drugdesign》(解析伊列乌斯病毒解旋酶的晶体结构,为揭示解旋酶的功能及药物设计提供启示)发表在国际著名期刊《Cell & Bioscience》(实时影响因子9.072, doi: 10.1186/s13578-022-00777-8),青年教师王德平博士、2020级硕士研究生王美月为本文共同第一作者。本研究得到了曹济民教授构建的结构生物学平台的全力支持,并成功发表了山西医科大学第一篇结构生物学领域的文章。
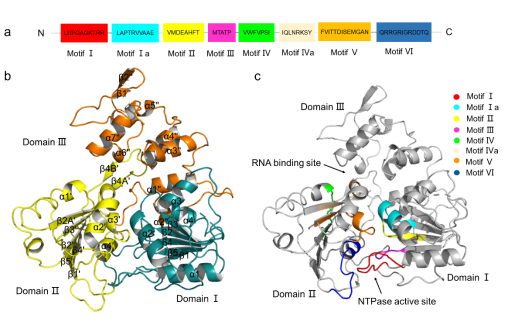
伊列乌斯病毒(ILHV)是与脑炎相关的、经节肢动物传播的黄病毒。首次于巴西东北部的伊列乌斯市发现并广泛传播至其他地域。目前并没有针对此种病毒感染的特效药物或疫苗。ILHV解旋酶和其他黄病毒解旋酶一样,具有5’-三磷酸酶活性,用于ATP水解以产生能量并在ILHV复制的过程中维持双链RNA的解旋。因此,ILHV解旋酶是设计抑制剂的理想靶点。本研究以1.75-Å高分辨率解析了ILHV解旋酶的晶体结构。
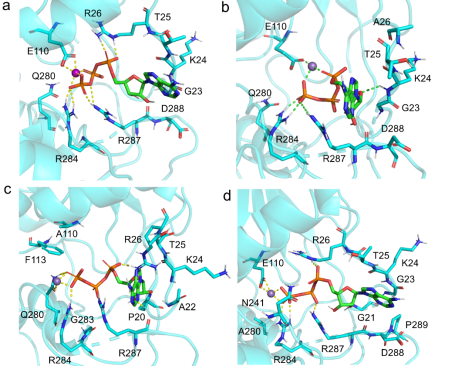
同时,本研究将对于解旋酶ATP水解活性至关重要的关键氨基酸位点R26, E110, Q280进行突变,并对wild-typehelicase及三种helicase突变体R26A, E110A, Q280A进行酶活性测定。结果表明,三种突变体的酶活性大大降低,表明此三个氨基酸位点对于解旋酶的ATP水解活性有重要作用。
最后,利用分子对接模拟了wild-type helicase及三种helicase突变体与ATP/Mn2+的结合模式;同时证明两种抑制剂,ST-610和苏拉明,具有抑制ILHV解旋酶活性的潜力。