我校曹济民教授团队在《Nano Research》发文:铂纳米粒子(PtNPs)通过破坏血管内皮屏障促进乳腺癌细胞转移
近期,细胞生理学教育部重点实验室曹济民教授团队在高水平国际学术期刊《Nano Research》(中科院一区top期刊,2022年影响因子10.269)发表了最新研究成果:《Platinum nanoparticles promote breast cancer cell metastasis by disrupting endothelial barrier and inducing intravasation and extravasation》(De-Ping Wang*, Jing Shen*, Yong-Mei Li, Chuan-Yue Qin, Li-Juan Gao, Yan-Ling Feng, Zi Yan, Xin Zhou#, Ji-Min Cao#. Nano Research 2022 May 31; https://doi.org/10.1007/s12274-022-4404-5)。该研究率先证明,PtNPs作为一种潜在癌症治疗剂,可能会促进乳腺癌转移,提示在设计纳米药物的过程中需妥善考虑纳米粒子的生物安全性,特别是其可能的促癌作用。
青年教师王德平博士和申晶博士为本文共同第一作者,曹济民教授和医学影像学院周鑫教授为本文通讯作者,这是该团队继2020年3月在《Particle and Fibre Toxicology》(中科院一区top期刊,最新影响因子9.112)发表学术论文后的又一重要研究成果。
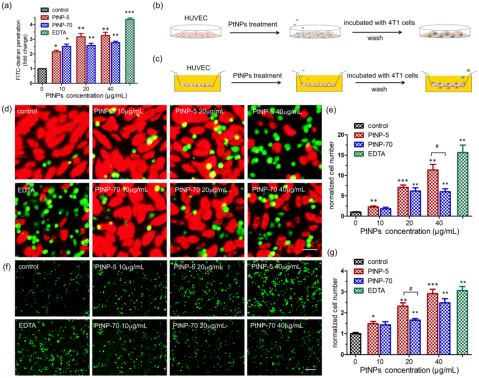
图1.PtNPs可诱发内皮细胞渗漏并引起4T1乳腺癌细胞的粘附
PtNPs由于具有良好的热稳定性和较高的光热转换效率,近年来在癌症光热治疗中受到了广泛的关注。PtNPs既可作为光动力和光热疗法的光敏剂,又可作为抗癌药物的载体。尽管目前认为PtNPs具有较好的抗癌作用,但其安全性仍有待评估。该研究发现,PtNPs可干扰血管内皮细胞的内皮钙粘蛋白(VE-cadherin)之间的相互作用,扰乱内皮细胞之间的连接,最终导致血管内皮渗漏,肿瘤细胞从原发肿瘤脱落,通过“内渗”方式进入血管,继而肿瘤细胞经血液循环在远达部位“外渗”出血管进入组织,形成转移灶。
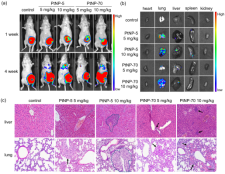
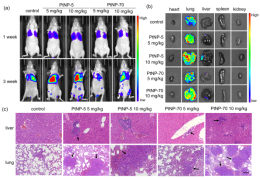
图2. PtNPs促进小鼠乳腺癌转移模型中癌细胞的内渗和外渗
进一步的机制研究显示,PtNPs通过刺激细胞内活性氧自由基(ROS)的产生,降低VE-cadherin的表达并破坏其连续性,抑制内皮细胞(HUVECs)的增殖、迁移和成管行为,最终导致血管内皮屏障受损。利用4T1-Luc乳腺癌细胞种植技术构建三阴乳腺癌原位癌和转移癌小鼠模型;静脉注射不同浓度的PtNPs观察其对乳腺癌转移的影响。小鼠活体成像结果显示,注射PtNPs的小鼠,其乳腺癌比对照组(未注射PtNPs)更容易出现转移灶,提示PtNPs具有促进乳腺癌转移的作用。此外,较小粒径的PtNPs(5 nm)比较大粒径的PtNPs(70 nm)有更强的内皮毒性及促乳腺癌转移的作用。该研究首次证明,用于乳腺癌治疗的铂纳米材料可通过破坏内皮屏障反而促进乳腺癌转移。研究提示,未来在利用纳米材料设计肿瘤治疗药物时,应考虑材料带来的可能有害影响。
