大家好!今天给大家介绍2021年12月发表在Molecular Therapy: Nucleic Acid(IF:8.886)上的一篇文章。本研究作者对骨肉瘤中的m6A修饰因子进行生物信息分析和实验验证,结果表明RBM15可以作为预测骨肉瘤转移和预后的有效生物标志物。
Analysis and identification of m6A RNA methylation regulators in metastatic osteosarcoma
分析和鉴定转移性骨肉瘤中的m6A RNA甲基化调控因子
01
摘要
骨肉瘤(OS)的特点是快速生长和早期转移,然而其机制尚不清楚。N6 -甲基化(m6A)修饰和调控因子在OS等大多数癌症中发挥重要作用。本研究中,作者使用TARGET数据库筛选到21个m6A修饰因子并鉴定关键的m6A甲基化修饰因子。结果表明有3个m6A甲基化调控因子RBM15,METTL3和LRPPRC的表达水平与OS患者的生存率较低有关。使用单因素和多因素Cox回归分析鉴定独立预后因子,转移是OS患者的独立预后因子。此外,作者发现RBM15与转移性OS有关,作者通过实验验证证明RBM15可以促进骨肉瘤细胞的侵袭,迁移和转移。总的来说,RBM15与OS转移和患者生存率较低有关,RBM15可以作为预测OS患者转移和预后的生物标志物。
02
流程图
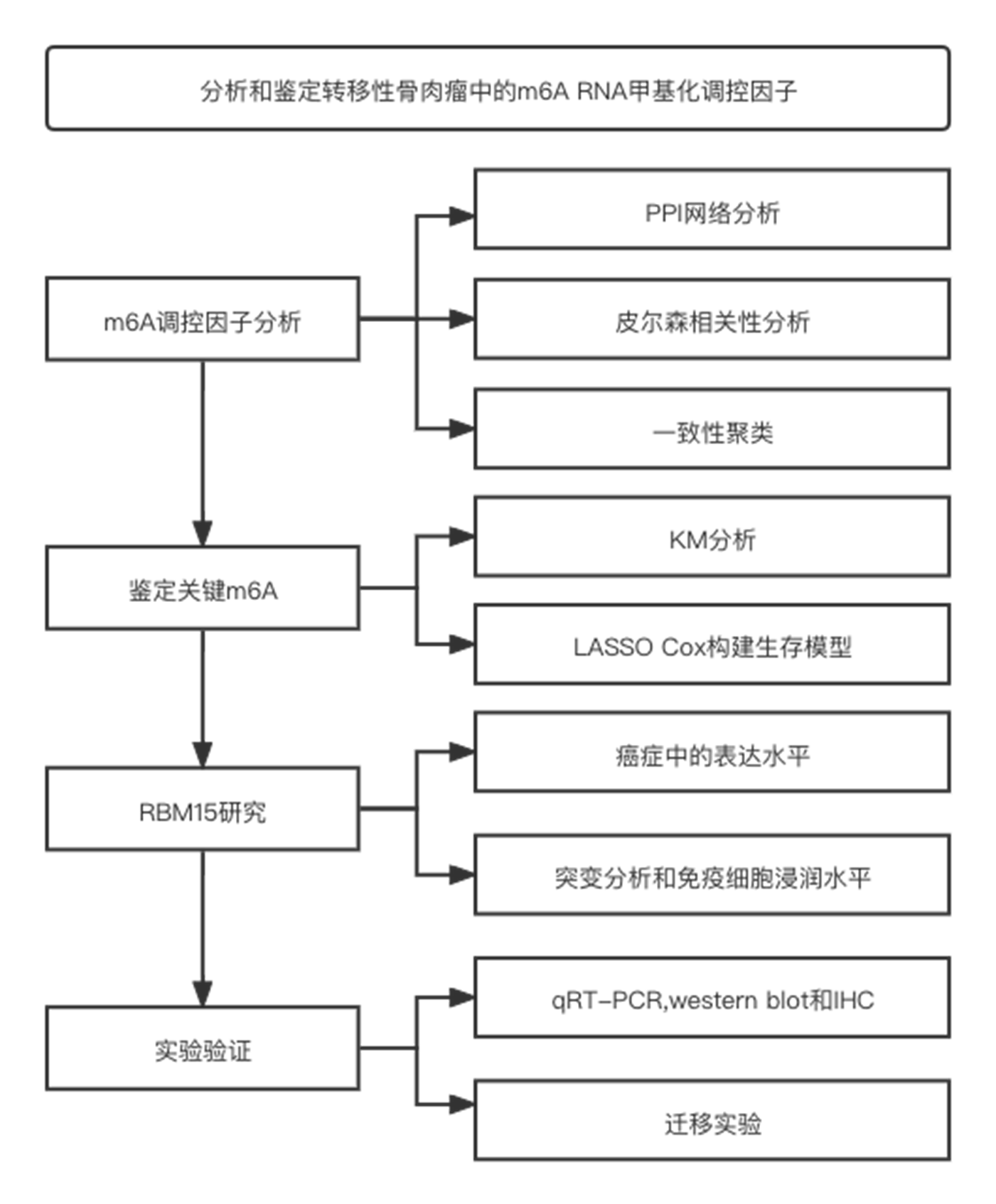
03
结果
1.数据集的获取和下载
从TARGET数据库获取88例OS患者的转录组数据集和临床数据集(表1)。
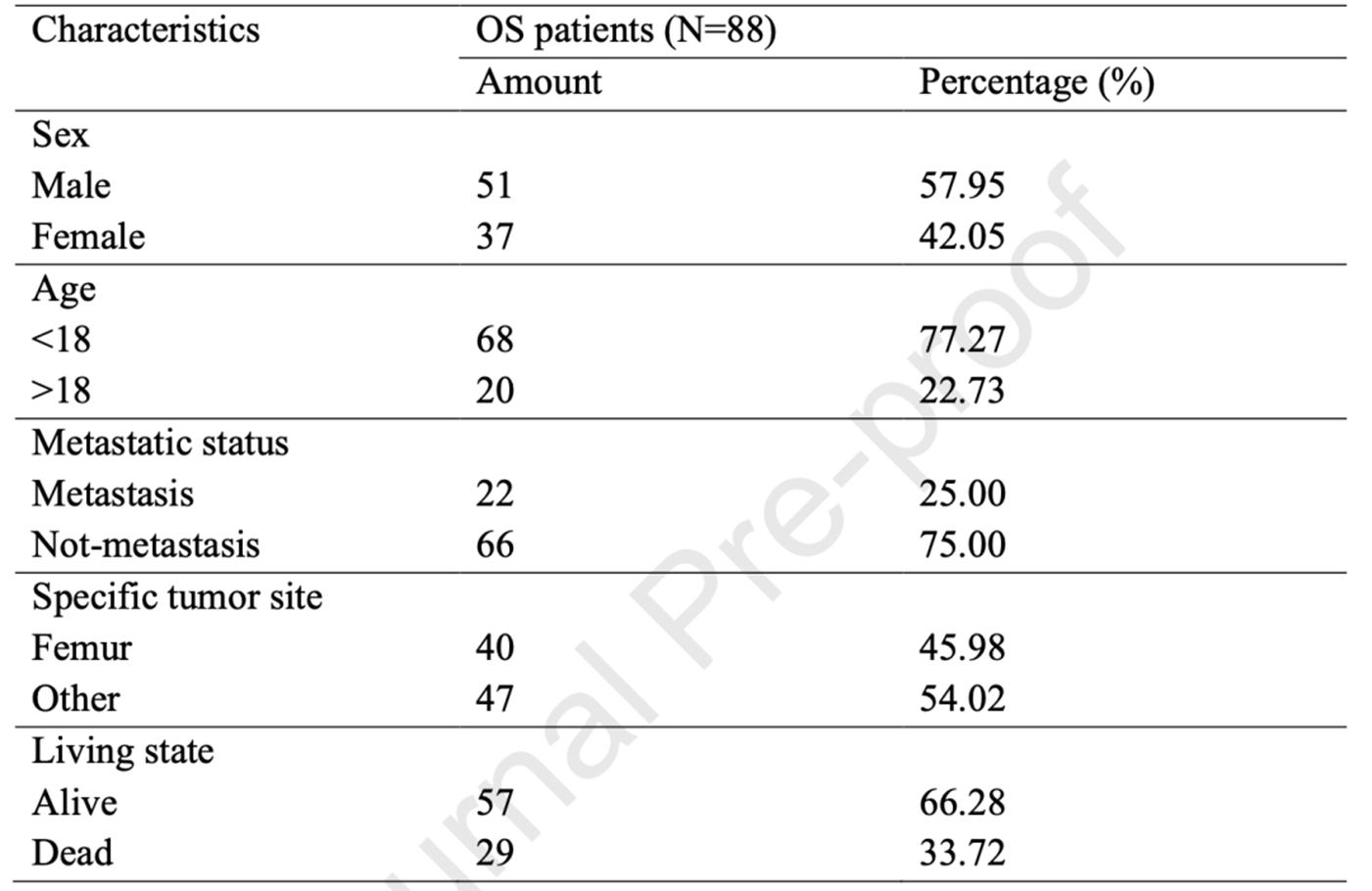
表1 OS患者的临床数据集
2. m6A调控因子的交互作用和相关性
由于m6A调控因子在肿瘤的发生发展中起到重要作用,作者对88例OS患者的21个m6A调控因子的数据进行全面分析。作者首先使用PPI网络分析这21个m6A调控因子的交互作用,结果表明有5个调控因子与其他调控因子的交互作用最高(图1A),且相关节点最多(图1B)。此外,使用皮尔森相关研究这21个调控因子的相关性,结果表明FTO与ALKBH5和RBM15负相关,而FTO与METTL3,METTL14和WTAP正相关。WTAP与METTL3和METTL14正相关。然而HNRNPC与其他调控因子相关性较差(图1C)。GO分析表明大部分调控因子富集到调控mRNA甲基化过程和调控mRNA稳定性(图1D)。
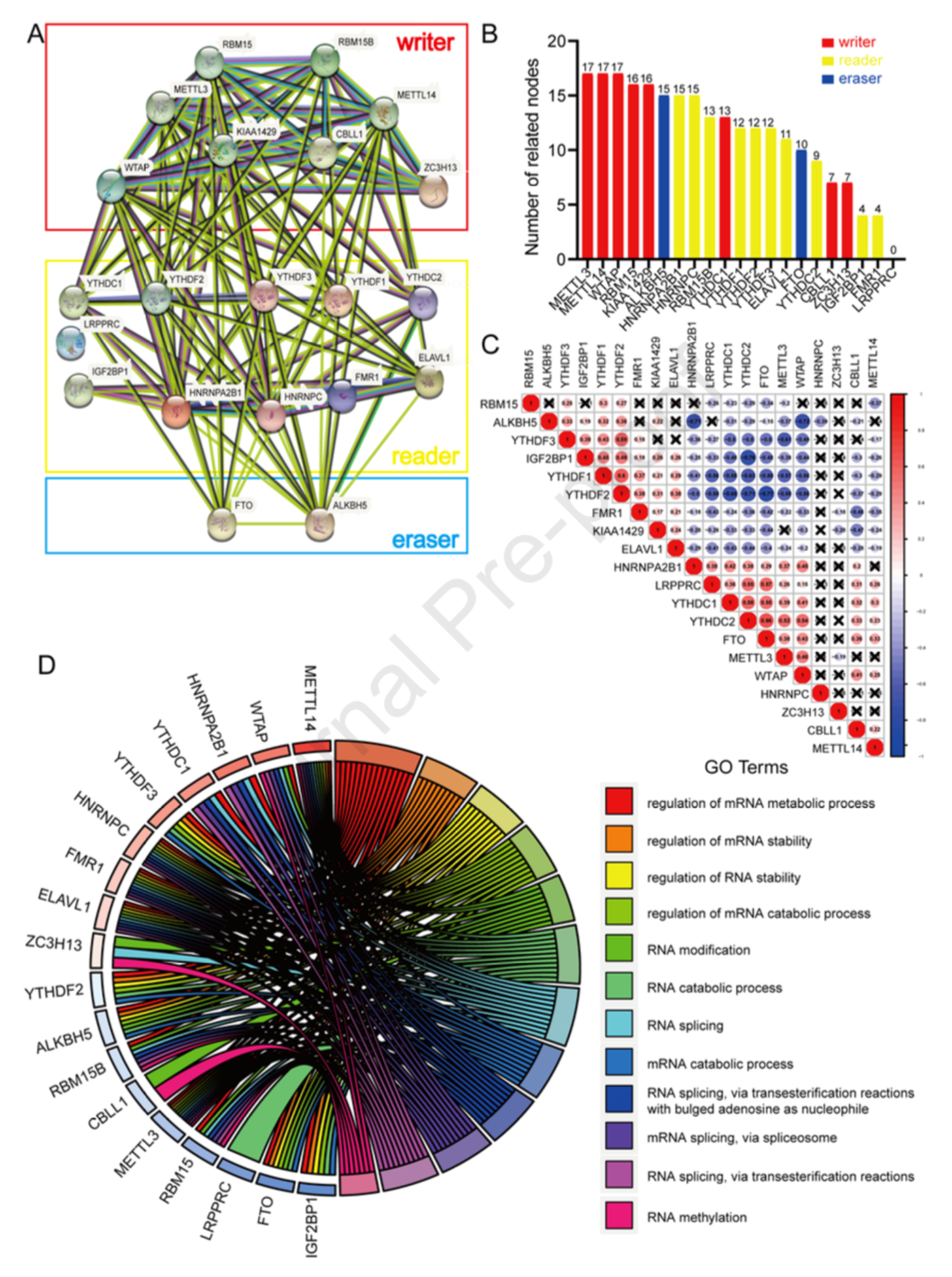
图1 21个m6A调控因子的交互作用和相关性
3.基于调控因子表达水平的一致性聚类
为研究m6A调控因子表达水平与OS患者预后的相关性,作者进行一致性聚类,共聚为3类(图2A和2B)。此外,根据组间的相关性表明样本可以分为3类(图2C)。对这3类进行生存分析表明这3类的生存情况具有显著差异(图2D)。此外,比较这3类的临床特征差异,发现这3类并没有显著差异。然而,这三类的m6A调控因子具有显著差异(图2E)。
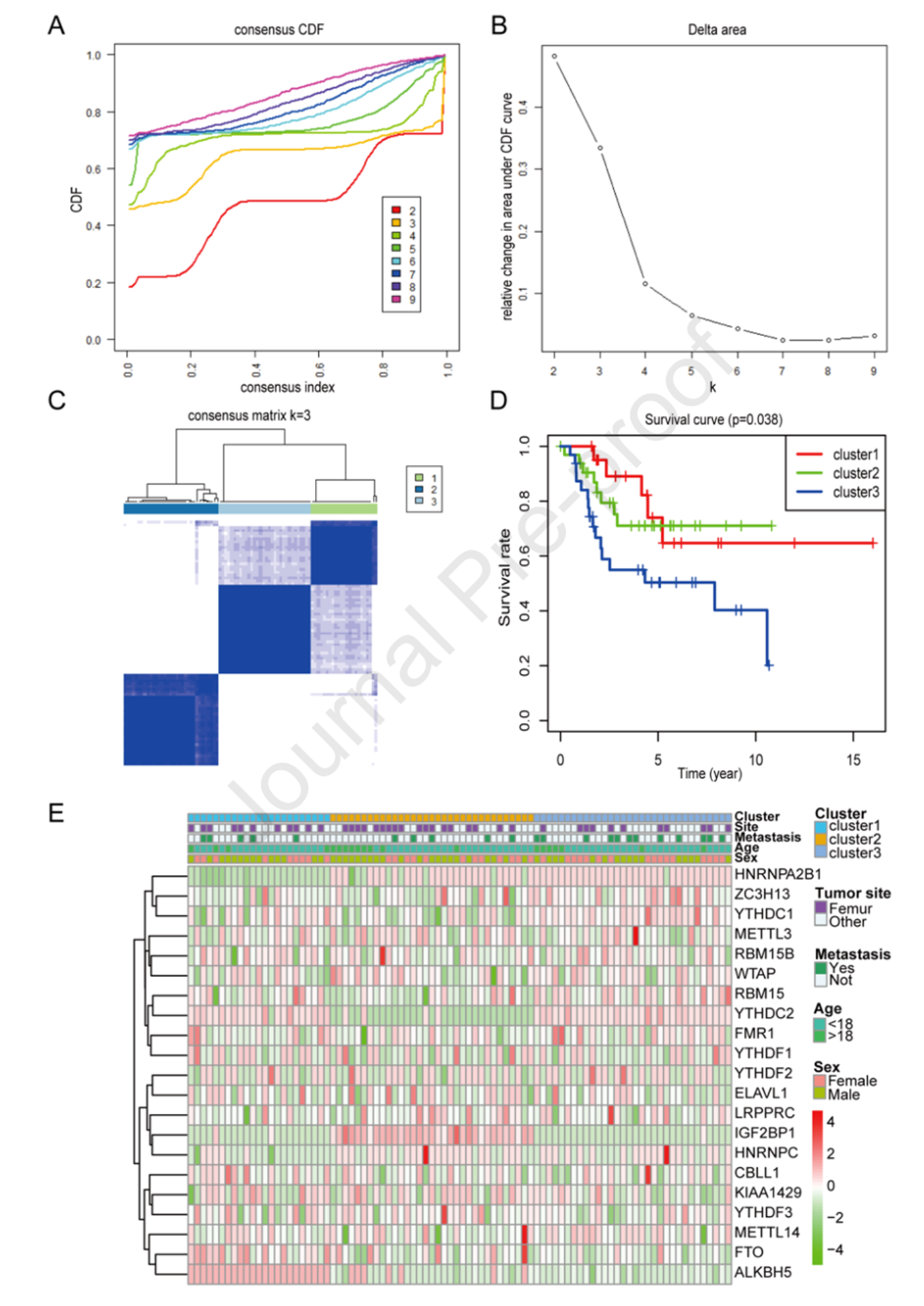
图2 m6A调控因子的一致性聚类
4.与OS预后较差的关键m6A调控因子
对这21个m6A调控因子进行生存分析进而筛选关键的调控因子。如图3A所示,有3个调控因子RBM15,METTL3和LRPPRC的p值最小且HR最大。RBM15,METTL3和LRPPRC的高表达与生存期较差有关,表明这3个调控因子是OS的高风险因子。此外,作者进行了LASSO Cox回归分析(图3B和3C)。

图3筛选3个关键的m6A调控因子
5.基于3个m6A调控因子构建生存模型
基于上面构建的风险打分将患者分为高风险组和低风险组。风险打分分布,生存时间和状态以及RBM15,METTL3和LRPPRC的表达水平如图4A所示。RBM15,METTL3和LRPPRC在高风险组中高表达。高风险组和低风险组的总生存期具有显著差异,高风险组的预后较差(图4B)。ROC曲线的AUC如图4C所示,1年,3年和5年的AUC均大于0.7。高风险组和低风险组的肿瘤位置,转移状态,年龄和性别没有显著相关性(图4D)。单因素Cox回归分析表明患者预后与转移,风险打分和聚类具有相关性而与性别,年龄和肿瘤位置没有相关性(图4E)。多因素Cox回归分析表明转移与预后显著相关(图4F)。
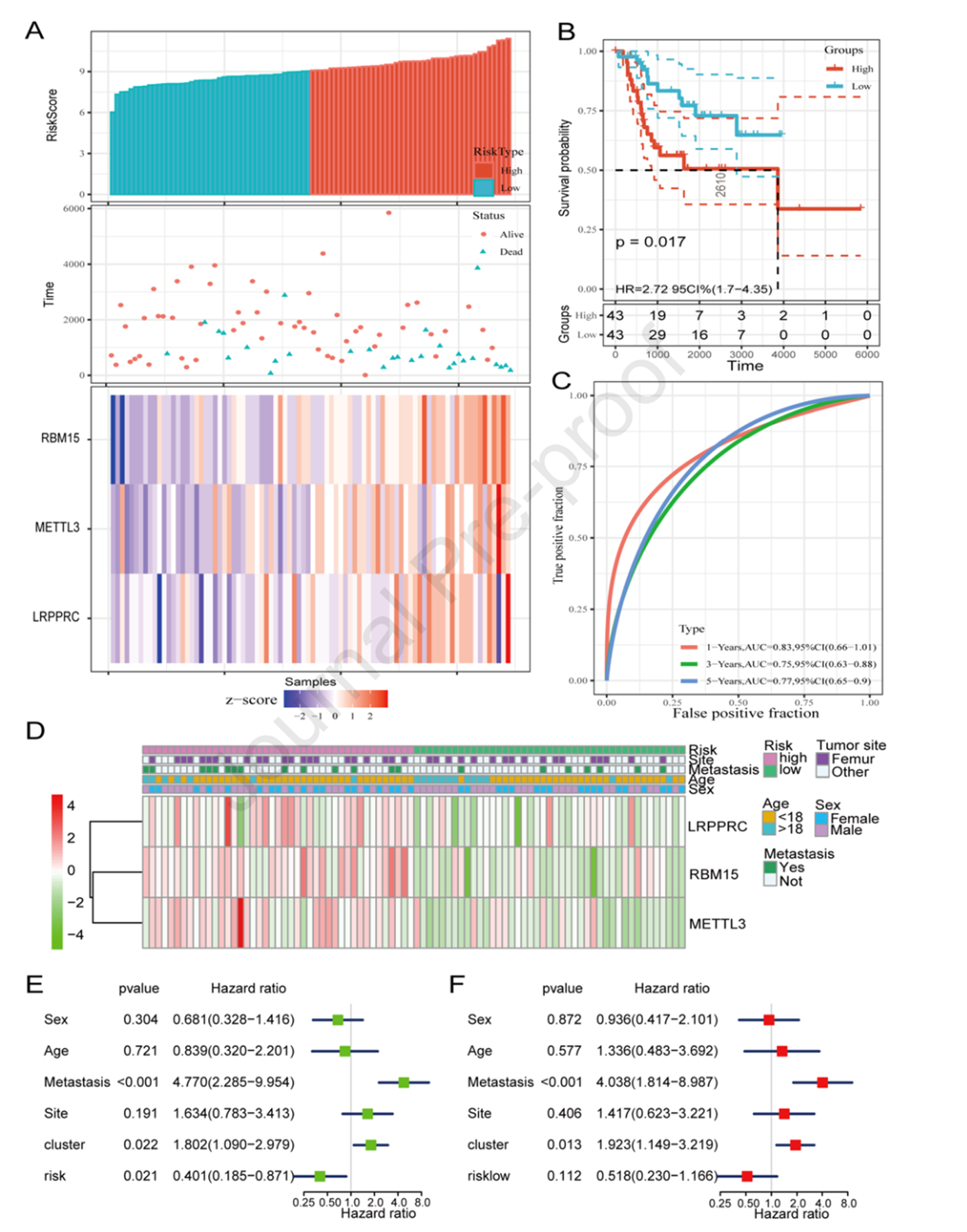
图4构建预后模型
6.在转移OS和非转移OS样本的m6A调控因子的表达水平
TARGET数据库获取的OS数据集共包括66例转移样本和22例非转移样本。RBM15和WTAP在转移样本中显著上调表达。然而,进一步研究表明只有RBM15在转移样本中显著过表达(图5)。说明,RBM15可能是关键的调控因子,在OS转移机制中具有重要作用。

图5 21m6A调控因子表达水平
7. RBM15在其他癌症中的表达水平
作者使用Oncomine数据库研究RBM15在不同类型OS中的拷贝数,RBM15在四个OS亚型中的拷贝数增加时间频率较高,表明RBM15在OS中的关键作用。此外,作者研究RBM15在其他癌症中的表达水平,RBM15在一些肿瘤中高表达。
8.RBM15突变分析和与免疫细胞浸润的相关性
作者使用SARC突变数据分析RBM15的突变状态。RBM15的体细胞突变频率为0.84%(图6A)。此外,使用CCLE数据库预测不同OS细胞系中RBM15中的甲基化状态(图6B)。此外,作者使用PPI网络构建RBM15的蛋白质相互作用,RBM15与RRN3和DIDO1相互作用。RBM15与这两个调控因子正相关。使用TIMER数据库研究免疫细胞浸润水平。如图6C所示,RBM15表达水平与CD4 T细胞,巨噬细胞和树突状细胞浸润水平负相关。这些结果表明RBM15在OS的免疫细胞浸润中起到重要作用。

图6 RBM15的突变状态,甲基化位置和免疫细胞浸润相关性
9.验证转移OS细胞系和人类临床样本中RBM15的表达水平
作者使用qRT-PCR和western研究RBM15在转移和未转移OS细胞系中的表达水平。图7A所示,在转移OS细胞系中RBM15的表达水平较高。western blot结果与之一致(图7B)。此外,作者使用IHC研究人类临床样本中RBM15的表达水平。如图7C所示,转移OS样本中RBM15蛋白表达水平较高。在转移OS细胞系中敲除RBM15(MNNG细胞系),在非转移性OS异细胞中转染表达载体RBM15(HOS细胞系)。如图7D和7E所示,在HOS细胞系的RBM15的表达水平明显增加,而MNNG细胞系中RBM15的表达水明显降低(图7F和7G)。
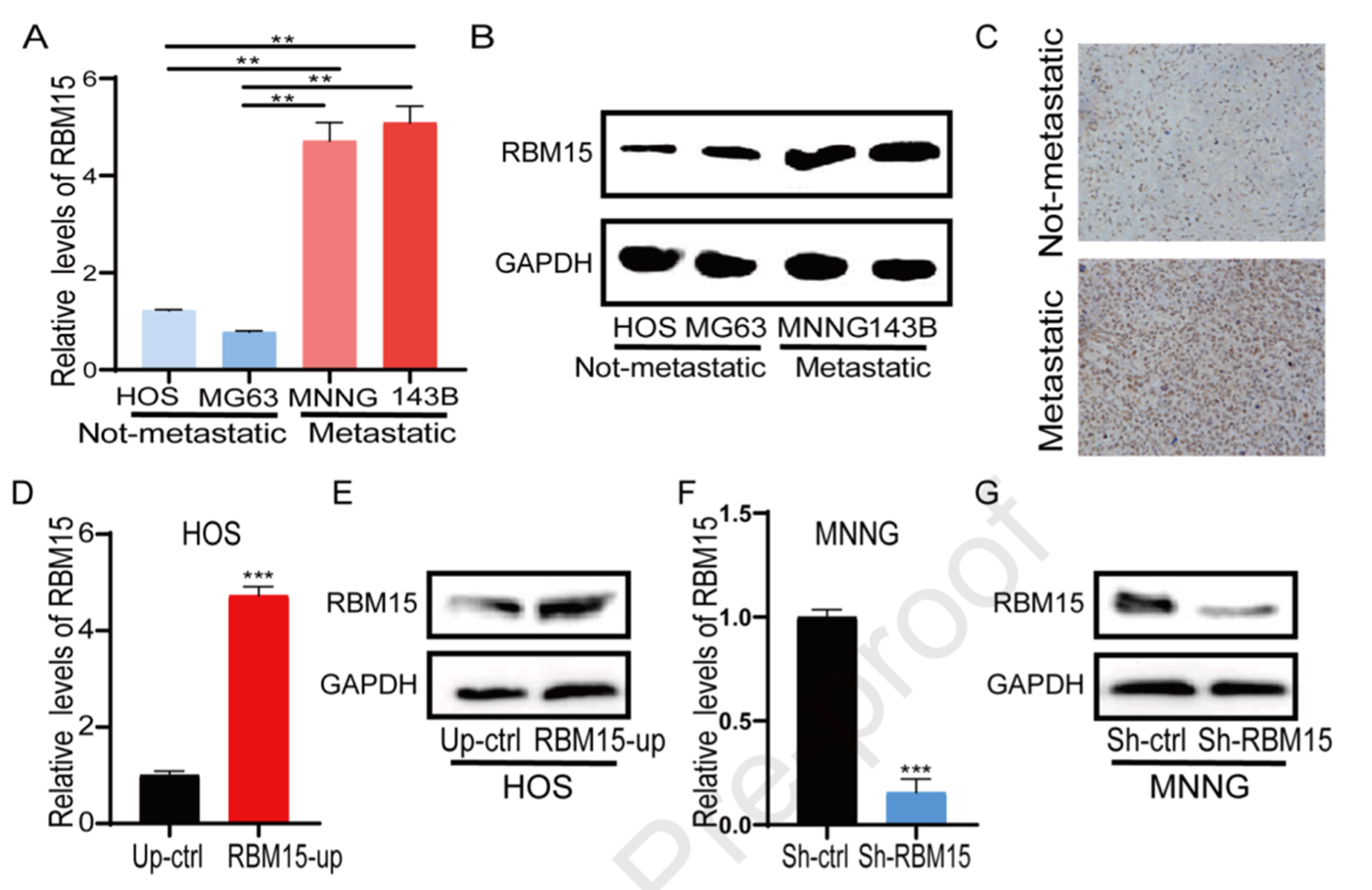
图7使用OS细胞系和人类临床样本验证RBM15的表达水平
10. RBM15促进OS细胞的迁移,增殖和转移
作者使用Transwell迁移实验研究RBM15在转移OS中的潜在调控作用。如图8A所示,在过表达RBM15后HOS细胞的迁移能力显著增加。在MNNG细胞中敲除RBM15后迁移能力降低。此外,过表达RBM15后HOS细胞的侵袭能力同样增加。此外,划痕实验结果表明过表达RBM15的HOS细胞治愈效果较好,而MNNG细胞的治愈效果较差(图8B)。图8C所示,过表达RBM15显著增加了非转移性OS细胞株的形成能力,而沉默RBM15显著破坏了OS细胞株的形成能力。CCK-8实验表明RBM15对维持OS细胞的高增殖了具有关键作用,过表达和敲除RBM15会显著增强和抑制OS细胞的活力(图8D)。作者将敲除RBM15的MNNG细胞注射到小鼠静脉,4周后采集小鼠组织进行分析。如图8E所示,与对照组相比处理组的小鼠OS细胞肺转移效果较低。总的来说,这些结果表明RBM15在OS细胞的运动和迁移中发挥重要作用。
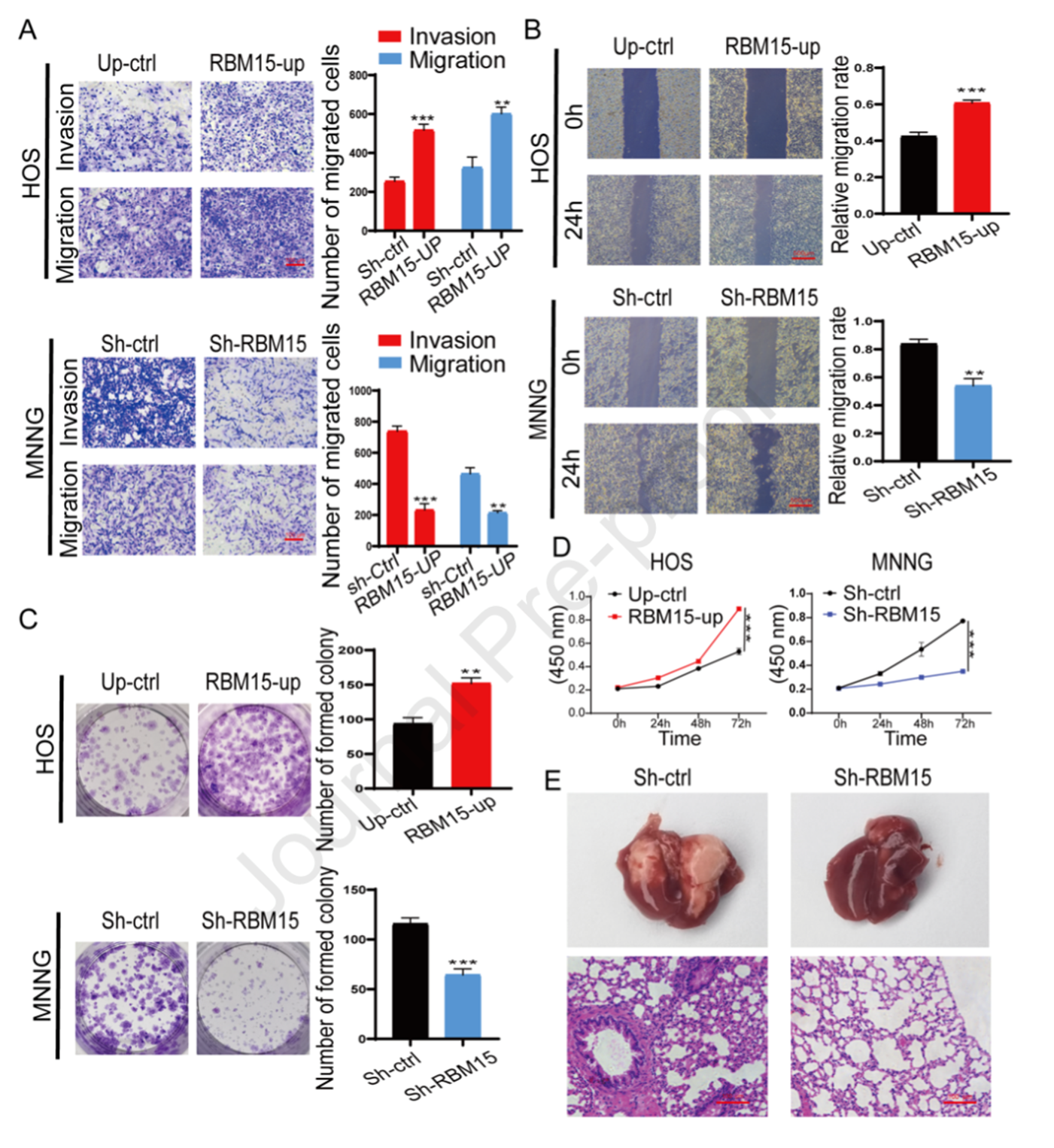
图8验证RBM15的侵袭,迁移,增殖和转移能力
04
结论
总的来说,作者分析了骨肉瘤中21个m6A调控因子的表达水平和预后价值。鉴定到3个关键m6A调控因子与OS的预后有关并构建预后模型。此外,作者鉴定到RBM15与骨肉瘤的转移有关并使用实验进行验证。结果表明RBM15在OS的发展和转移中起到重要作用,可以作为预测OS转移和预后的关键生物标志物。
转载自公众号《生信发文助手》,如有侵权,请联系删除。