大家好!今天给大家介绍一篇2021年10月发表在Cancer Immunology, Immunotherapy(IF:6.968)上的文章。本研究作者全面评估了LSCC患者的免疫微环境并构建可以准确预测LSCC患者生存情况的风险模型。
Assessment of immune status of laryngeal squamous cell carcinoma can predict prognosis and guide treatment
评估喉鳞状细胞癌免疫状态预测预后和指导治疗
01
摘要
背景:目前,免疫治疗已经改变了医生治疗癌症的方法。喉鳞状细胞癌(LSCC)的免疫微环境受到了大家的广泛关注。
方法:本研究作者对412例原发性LSCC患者的肿瘤免疫微环境(TME)进行分析研究患者的生存期与局部组织和免疫状态的关系。作者构建和评估了可以预测患者预后和评估免疫状态的风险模型,将患者分为不同风险亚组。此外,通过免疫组化分析作者鉴定到CTSL和KDM5D在LSCC组织中差异表达和对预后及肿瘤浸润性淋巴细胞的影响。
结果:作者鉴定到间质性肿瘤浸润性淋巴细胞,肿瘤实质浸润淋巴细胞,肿瘤浸润边界淋巴细胞和血小板/淋巴细胞比(PLR)是LSCC患者的独立预后因子。作者构建的风险模型可以准确预测患者预后并鉴定高风险组患者。此外,CTSL和KDM5D等基因的差异表达与LSCC患者的预后显著相关。
结论:喉鳞状细胞癌(LSCC)患者的局部和系统性炎症标志物可以作为患者的有效预后因子。风险模型和CTSL,KDM5D是具有潜在的临床价值。
02
流程图
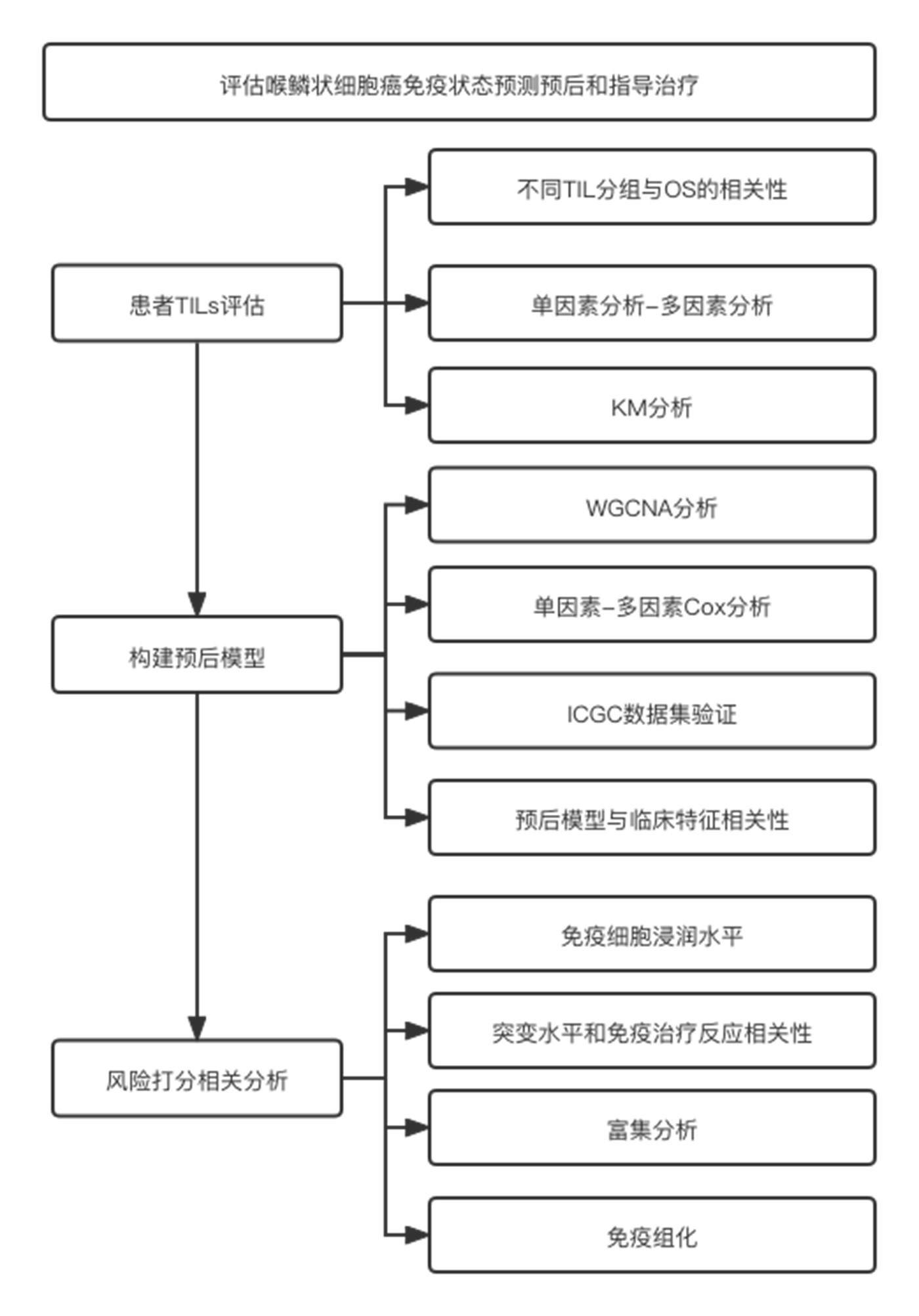
03
结果
1.数据集的获取和下载
本研究的实验样本来自哈尔滨医科大学肿瘤医院的412例喉鳞状细胞癌患者,包括336名男性和76名女性。72.1%的患者具有吸烟史,52.2%的患者为声门上鳞状细胞癌,47.8%的患者为声门喉部鳞状细胞癌(表1)。从TCGA数据库下载111例LSCC患者的RNA-seq数据和临床数据。
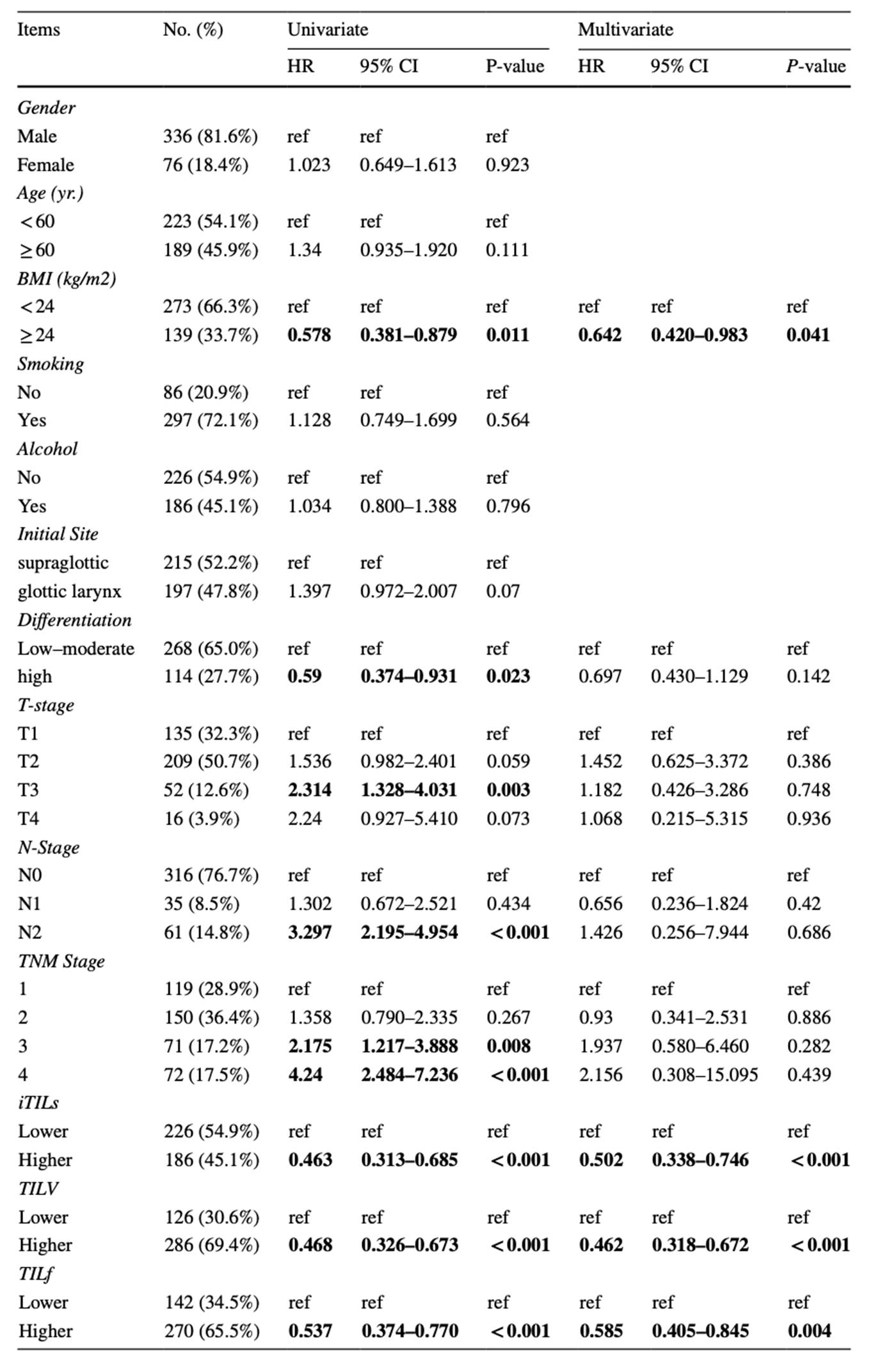
表1患者临床特征和单因素及多因素分析
2.肿瘤局部炎症浸润指标外周血炎症标志物的预后价值
有226例患者iTILs较低,186患者iTILs较高,高iTILs患者的5年OS较高(图1a)。根据TILv分组有126例患者TILv较低,286例患者TILv较高,高TILv患者的5年OS较高(图1b)。根据TILf分组有142例患者TILf较低,270例患者TILf较高,高TILf患者的5年OS较高(图1c)。总的来说,iTILs,TILv和TILf水平与患者总生存期显著相关。此外,ROC曲线表明iTILs,TILv和TILf的预测性能较好(图1d)。单因素分析表明,BMI≥24,低分化,声门上癌,T分期,N分期和TNM分期较高,iTILs,TILv和TILf较低与预后不良有关。多因素分析表明,BMI,iTILs和TILf与预后有关(表1)。结果表明,高iTILs,TILv和TILf是预后独立因子。KM分析表明,LMR,PLR,NLR和SII与患者OS有关(图1e-1h)。单因素Cox分析表明PLR,NLR和SII较高与OS较高有关,多因素分析表明PLR是独立预后因子(表2)。
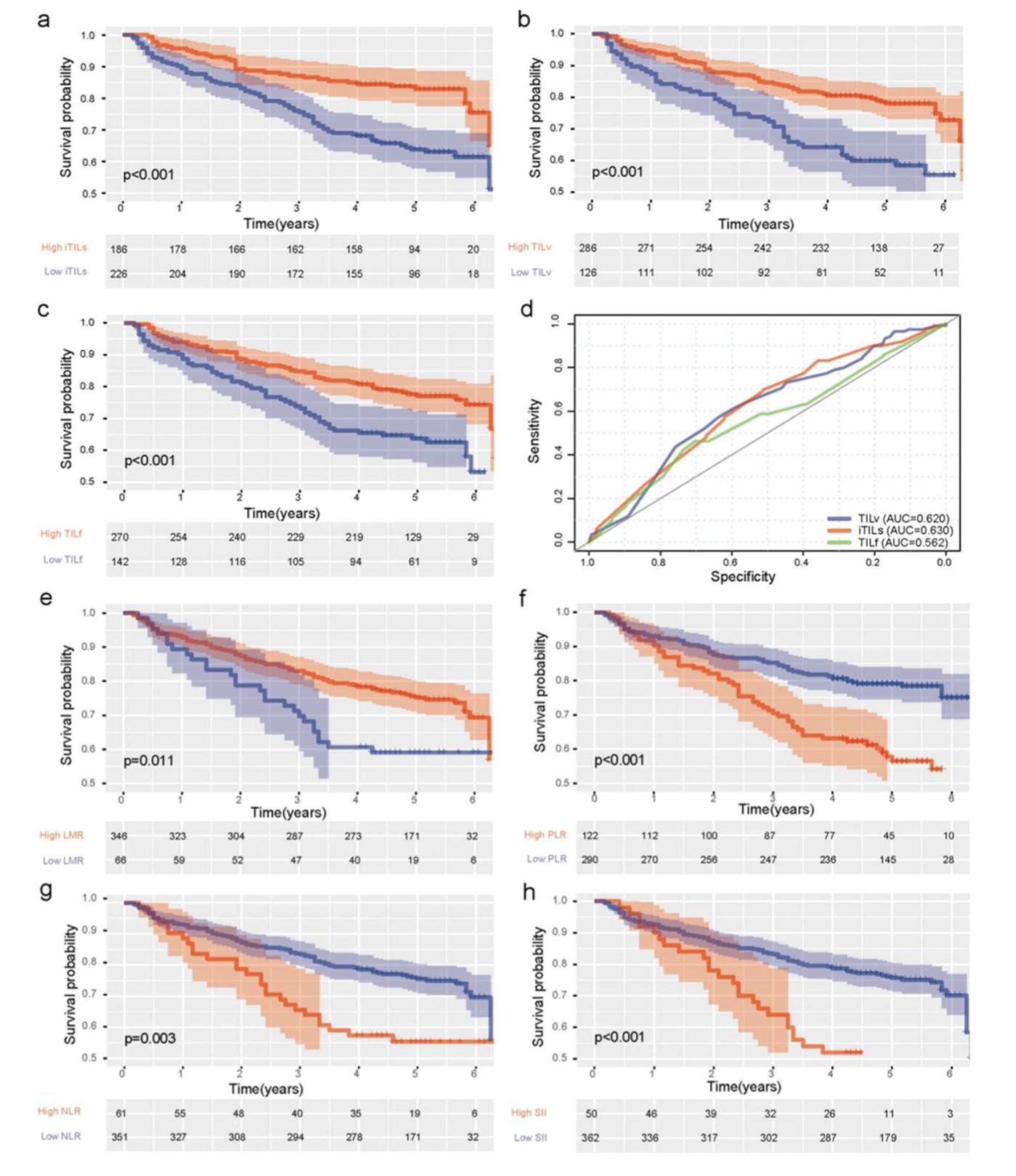
图1炎症因子和预后的相关性
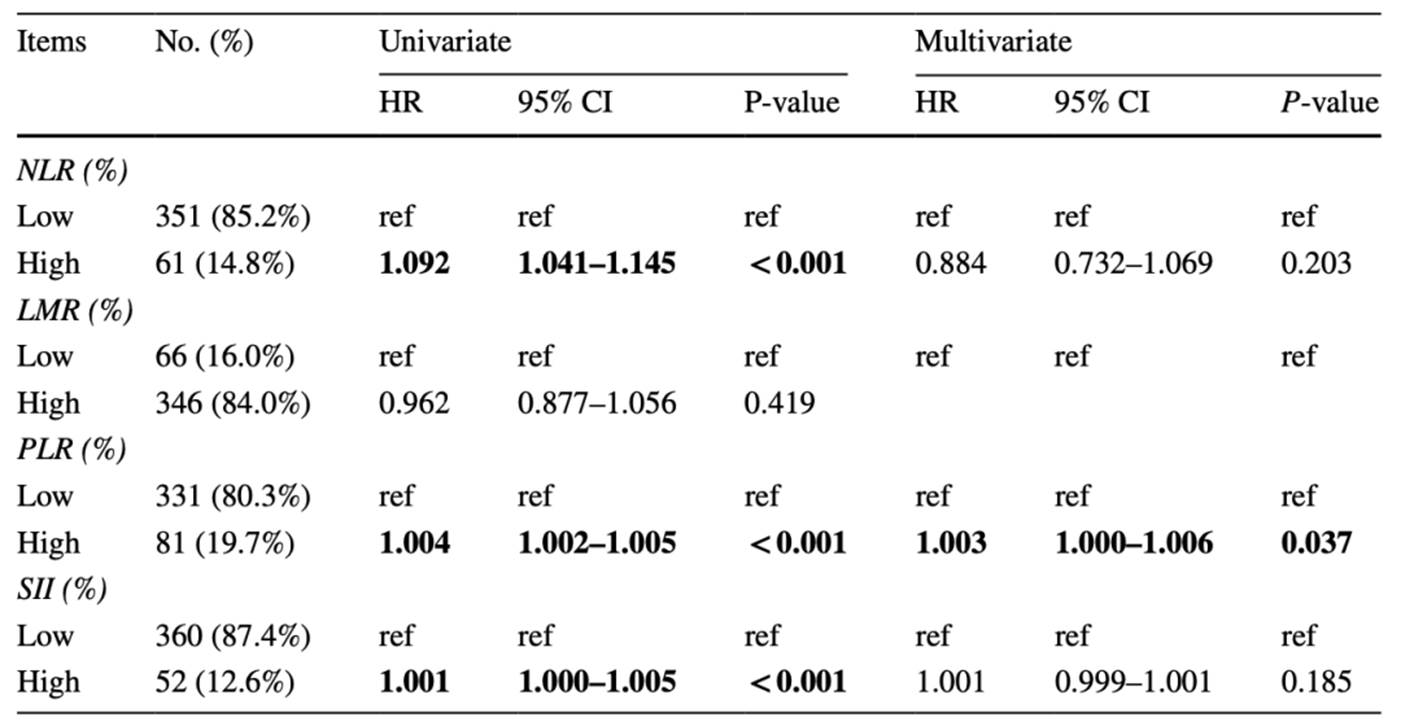
表2炎症因子和OS的单因素及多因素分析
3. TCGA-LSCC患者的TILs与预后的关系
作者对TCGA-LSCC数据集进行ssGSEA分析并根据TILs富集情况将TCGA-LSCC患者分组。KM分析表明高TILs组的生存期较长(图2a)。Pearson相关性分析表明生存时间与TILs打分有关(图2b)。
4.筛选与TILs有关的共表达模型并对关键基因进行功能分析
作者TCGA-LSCC数据集进行过滤,对过滤后的102个样本的6322个基因进行WGCNA分析鉴定到17个模块,其中蓝色模块与TILs和免疫检查点(ICP)水平显著相关(图2c)。将ICP相关基因与TIL相关基因取交集得到802个基因(图2d)。对这些基因进行GO和KEGG富集分析,KEGG分析表明,这些基因主要参与调控肿瘤中细胞因子-细胞因子受体互作,趋化因子信号通路,T细胞和B细胞受体信号通路等(图2e)。GO分析表明,这些基因主要富集于T细胞活化,免疫效应过程调控和淋巴细胞增殖等过程(图2f)。
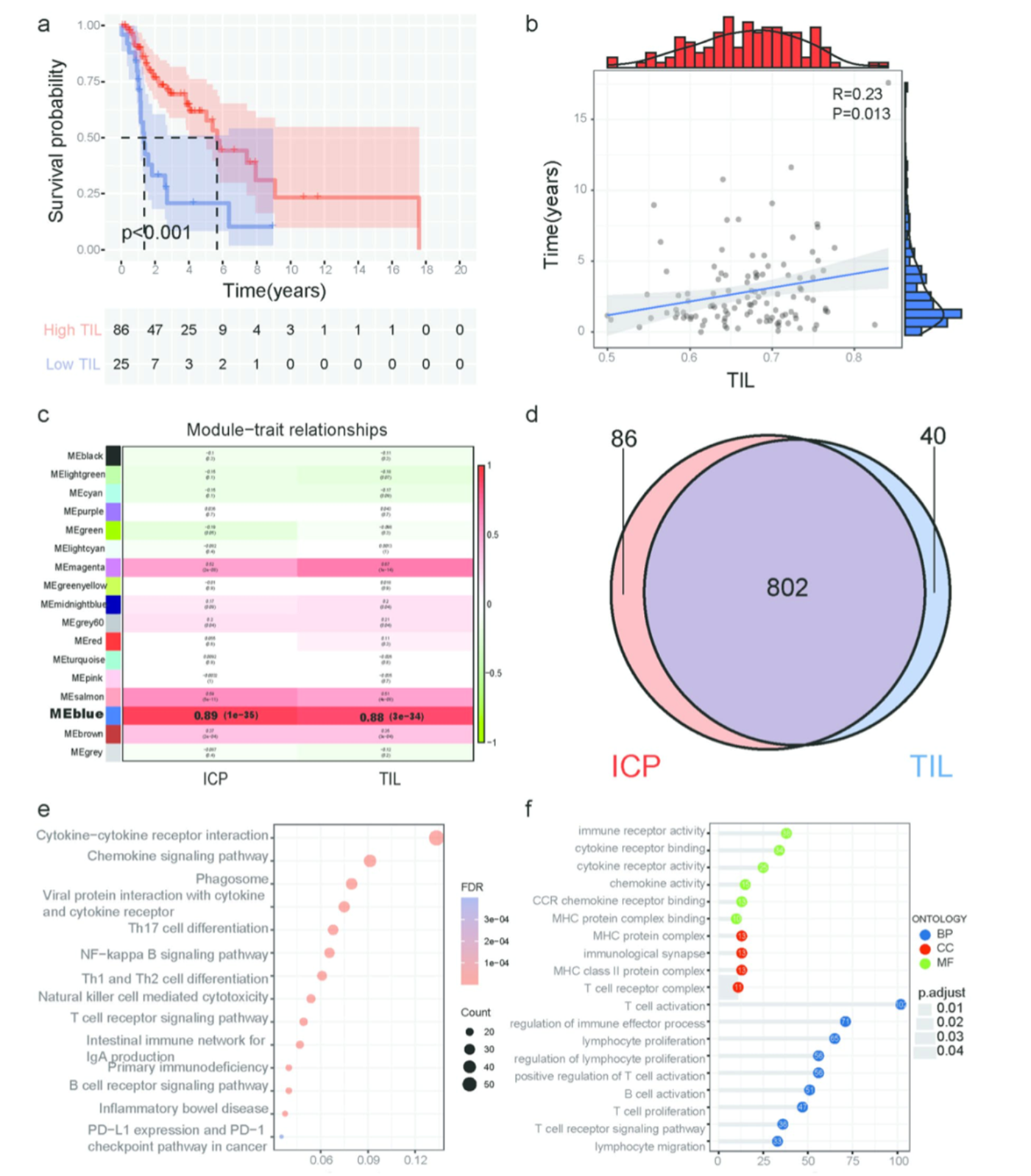
图2 TILs的预后价值和TIL相关基因富集分析
5.构建和验证预测模型
对WGCNA核心基因进行单因素Cox分析,有69个核心基因与预后有关,随后进行LASSO Cox回归分析筛选到19个核心基因。对这19个基因构建预后模型,ROC曲线的AUC为0.790(图3a)。随后,作者绘制时间依赖性ROC曲线,1年,3年和5年的AUC分别为0.811,0.953和0.939(图3b)。根据风险打分将患者分为高风险组和低风险组,其中高风险组患者的总生存期较低(图3c)。随风险打分增加,患者的死亡率逐渐增加生存时间逐渐减少(图3d)。随风险打分增加,NUPR2,MT-ATP8和AQP9的表达水平增加而KDM5D, MAP3K14, TNFRSF4的表达水平减少(图3e)。
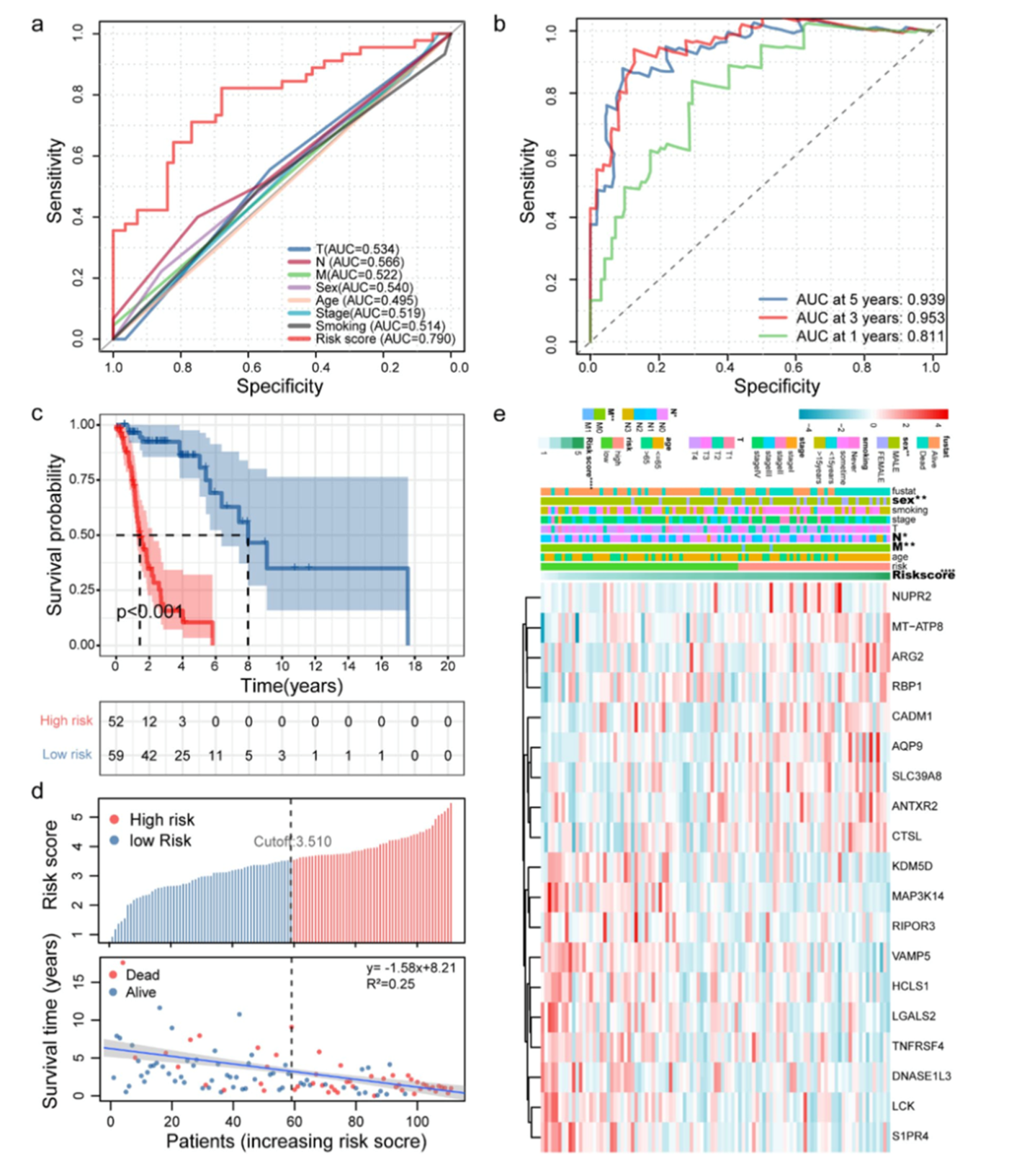
图3 TIL相关基因风险打分分析
6. ICGC数据集验证
作者对85例ICGC数据集计算风险打分并分为不同风险亚组。1年,3年和5年ROC曲线的AUC分别为0.628,0.815和0.821。低风险组患者的总生存期较高,随风险打分增加患者死亡率逐渐升高而生存时间逐渐降低。
7.预测模型与临床特征的相关性
单因素分析表明,风险打分,M分期,N分析和性别与OS显著相关(图4a)。多因素分析表明风险打分和M分期是预后独立因子(图4b)。随后,作者基于WGCNA核心基因构建列线图(图4c),C-index为0.835,校准曲线和DCA图表明列线图性能较好(图4d和4e)。
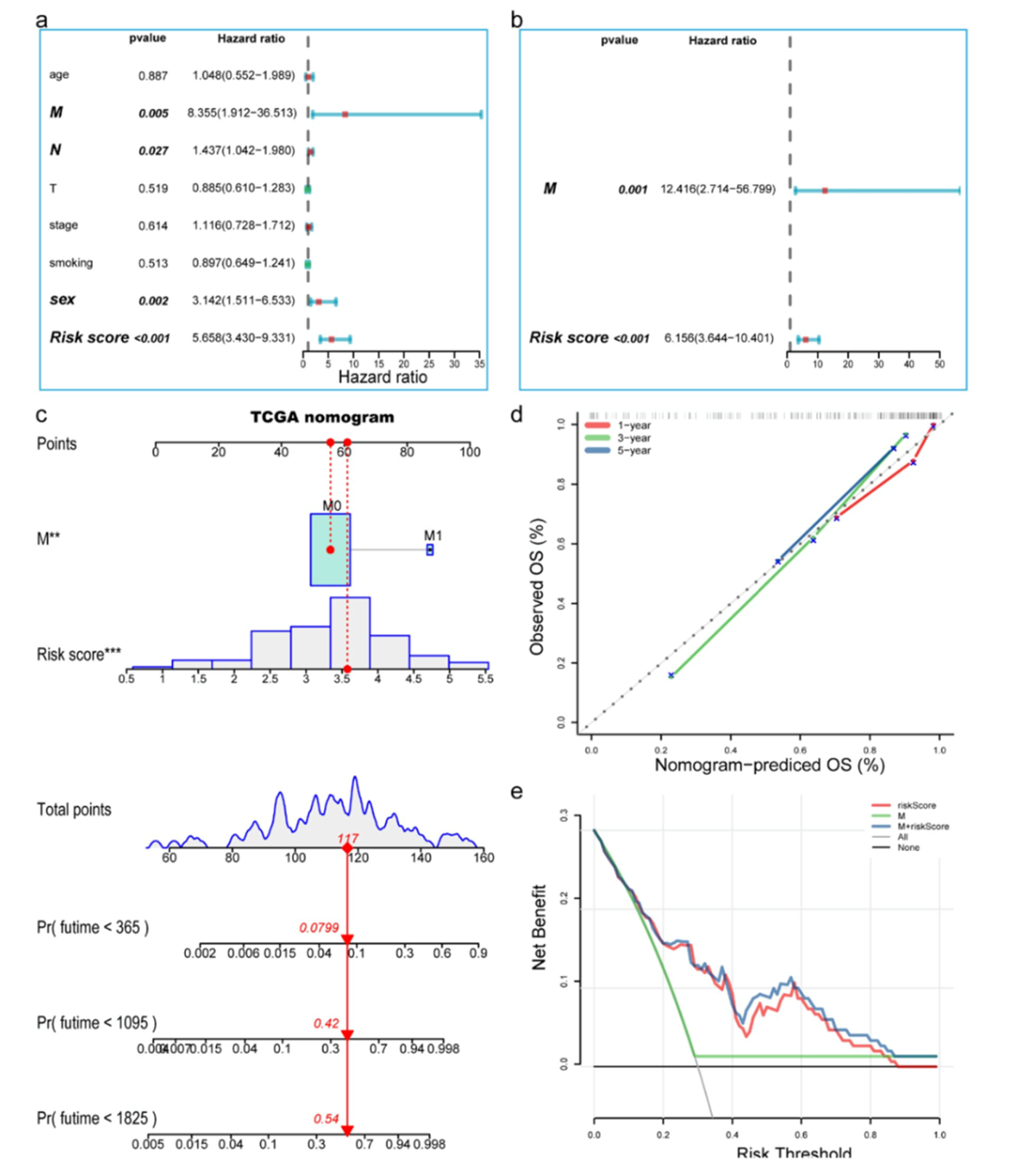
图4构建列线图
8.免疫细胞浸润和风险模型的相关性
作者根据ESTIMATE计算LSCC患者的免疫打分,低风险组的免疫打分较高与风险打分负相关(图5a和5b)。使用MCP方法计算10种免疫相关细胞的丰度,低风险组中CD8 T细胞,骨髓树突状细胞,中性粒细胞和T细胞丰度较高(图5c)。免疫细胞浸润水平和风险打分的相关性分析表明,免疫细胞浸润水平与风险打分负相关(图5d)。使用CIBERSORT方法计算22种免疫细胞浸润水平(图5e),其中低风险组中CD8 T细胞和CD4 T细胞浸润比例较高,而高风险组中M0巨噬细胞和嗜酸性粒细胞浸润比例较高。
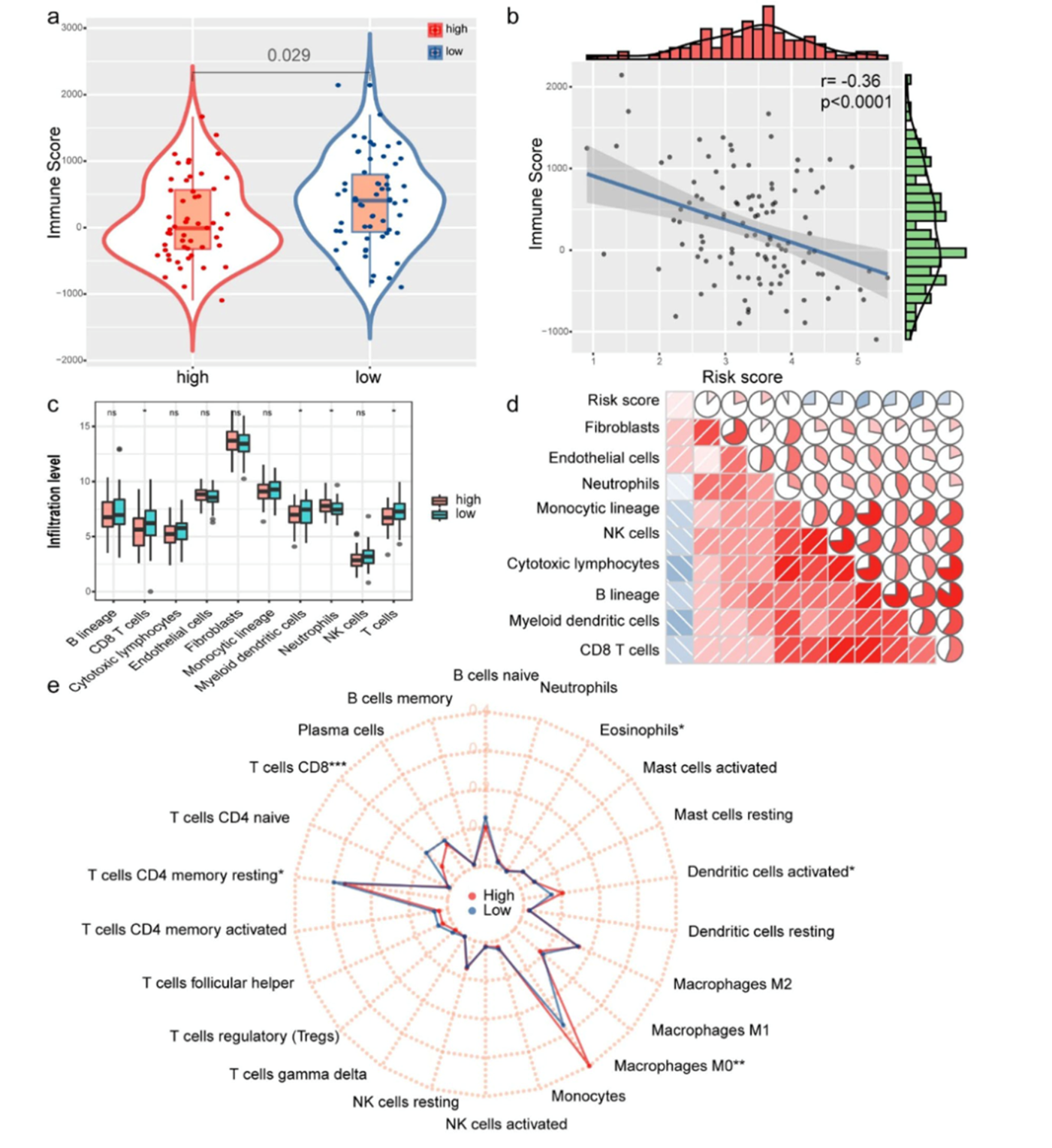
图5免疫细胞浸润和免疫打分与风险打分的相关性
9. ICGC数据集突变分析和免疫治疗反应评估
作者分析ICGC数据集的突变水平和TMB,高风险组和低风险组突变频率最高的20个基因如图6a和6b所示,低风险组的TMB较高(图6c)。免疫检查点表达水平分析表明,低风险组中LAG3和PDCD1的表达水平较高,LAG3,PDCD1和CD274表达水平与风险打分负相关(图6d和6e)。
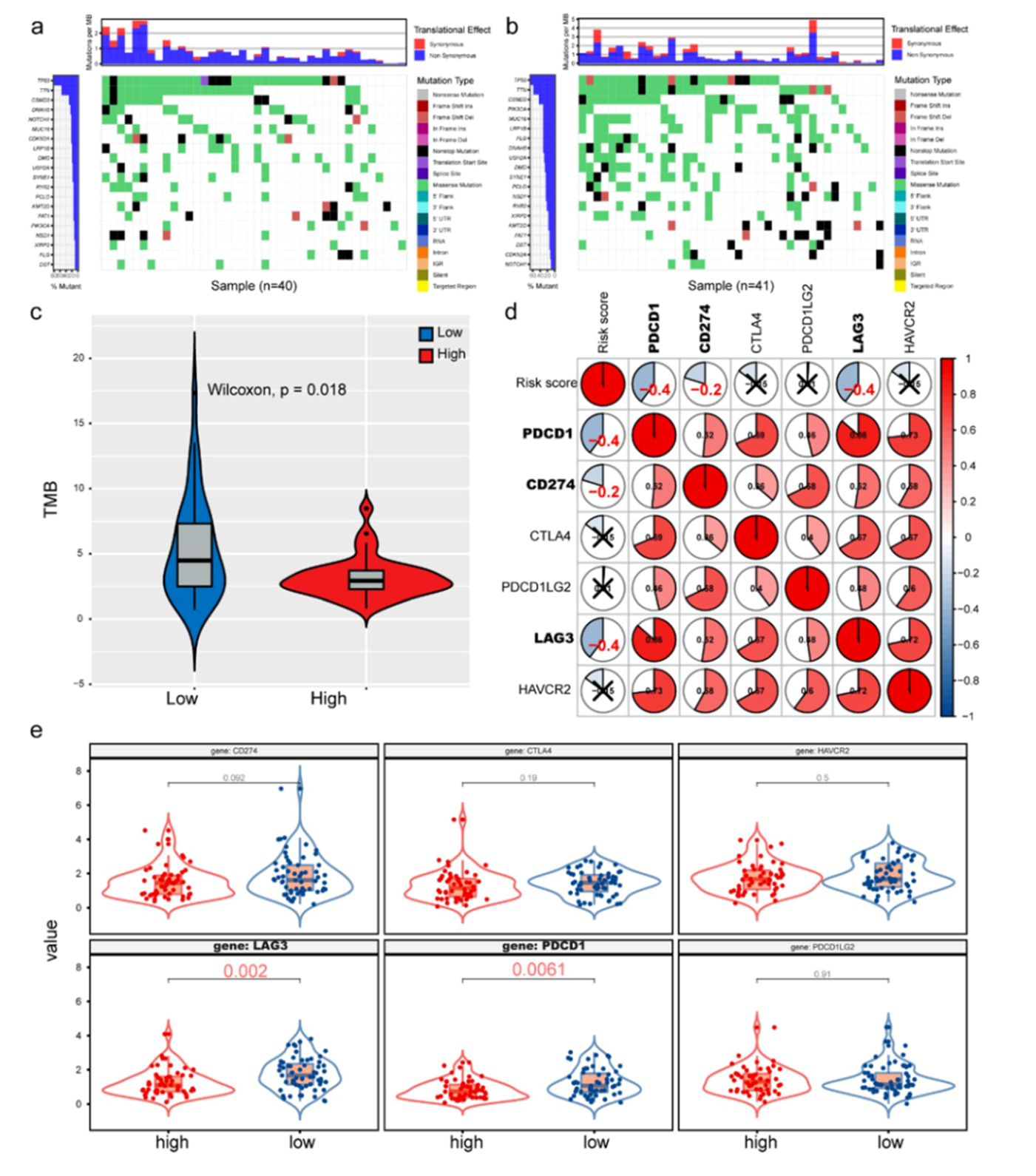
图6风险打分和免疫治疗的相关性
10.风险模型的基因富集分析
对高风险组和低风险组进行差异分析,对差异基因进行KEGG富集分析。结果表明,差异基因富集于9条KEGG通路,其中高风险组显著富集TGC-β信号通路和ECM受体通路而低风险组显著富集原发性免疫缺陷通路(图7a)。GSEA分析表明共富集9个hallmark基因集(图7b),其中缺氧,KRAS_SIGNALING_UP和MTORC1_SIGNALING与风险打分较高有关,说明这些过程可能参与LSCC的发展。
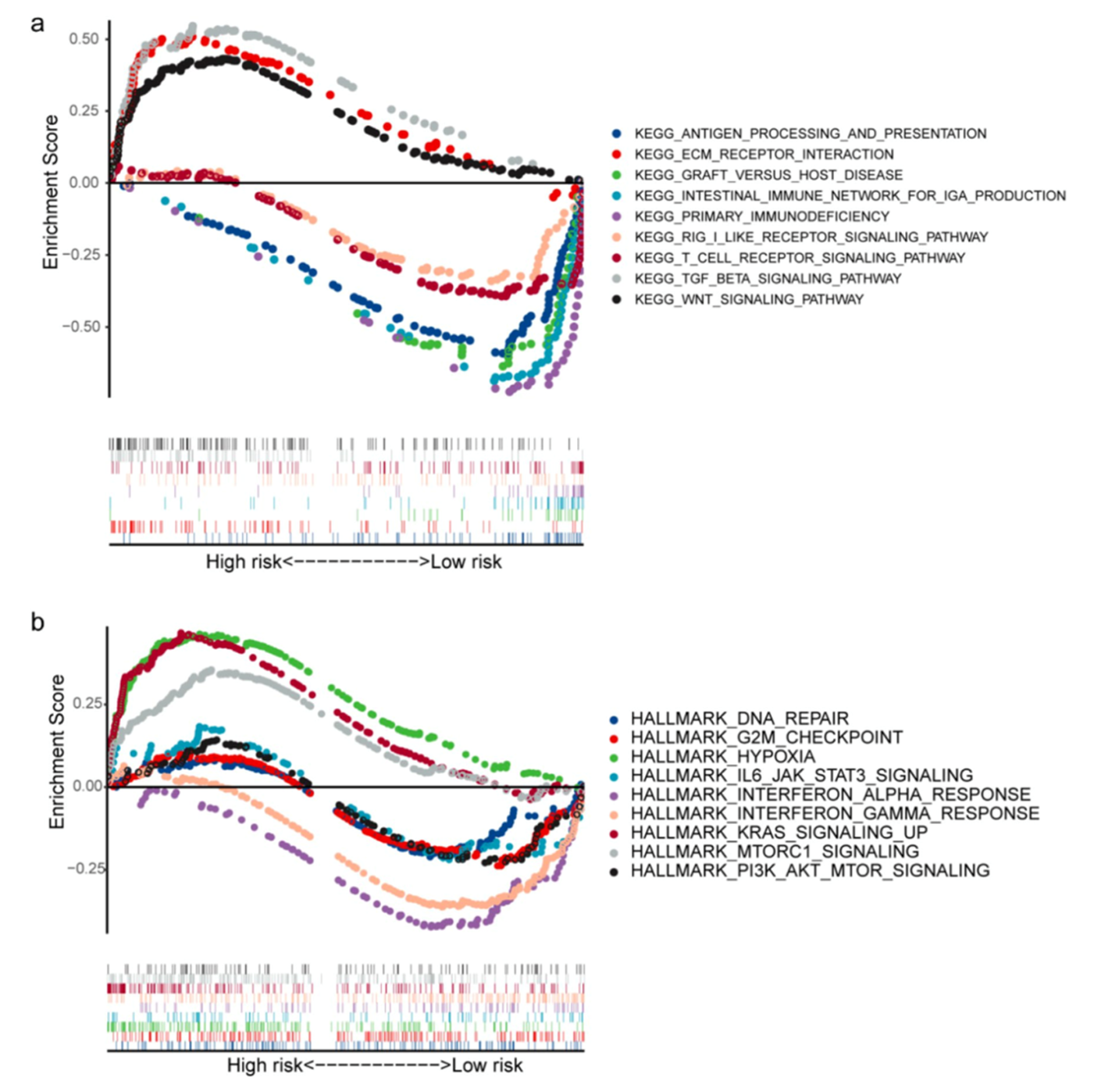
图7富集分析
11.免疫组化
免疫组化分析表明,有11例患者的CTSL高表达,300例患者的CTSL低表达(图8a)。CTSL高表达组的OS率低于CTSL低表达组(图8b)。根据KDM5D表达水平将患者分为KDM5D高表达组和低表达组(图8a)。KDM5D高表达组的OS率高于KDM5D低表达组(图8c)。CTSL表达水平与TILs负相关而KDM5D表达水平与TILs正相关(图8d和8e)。
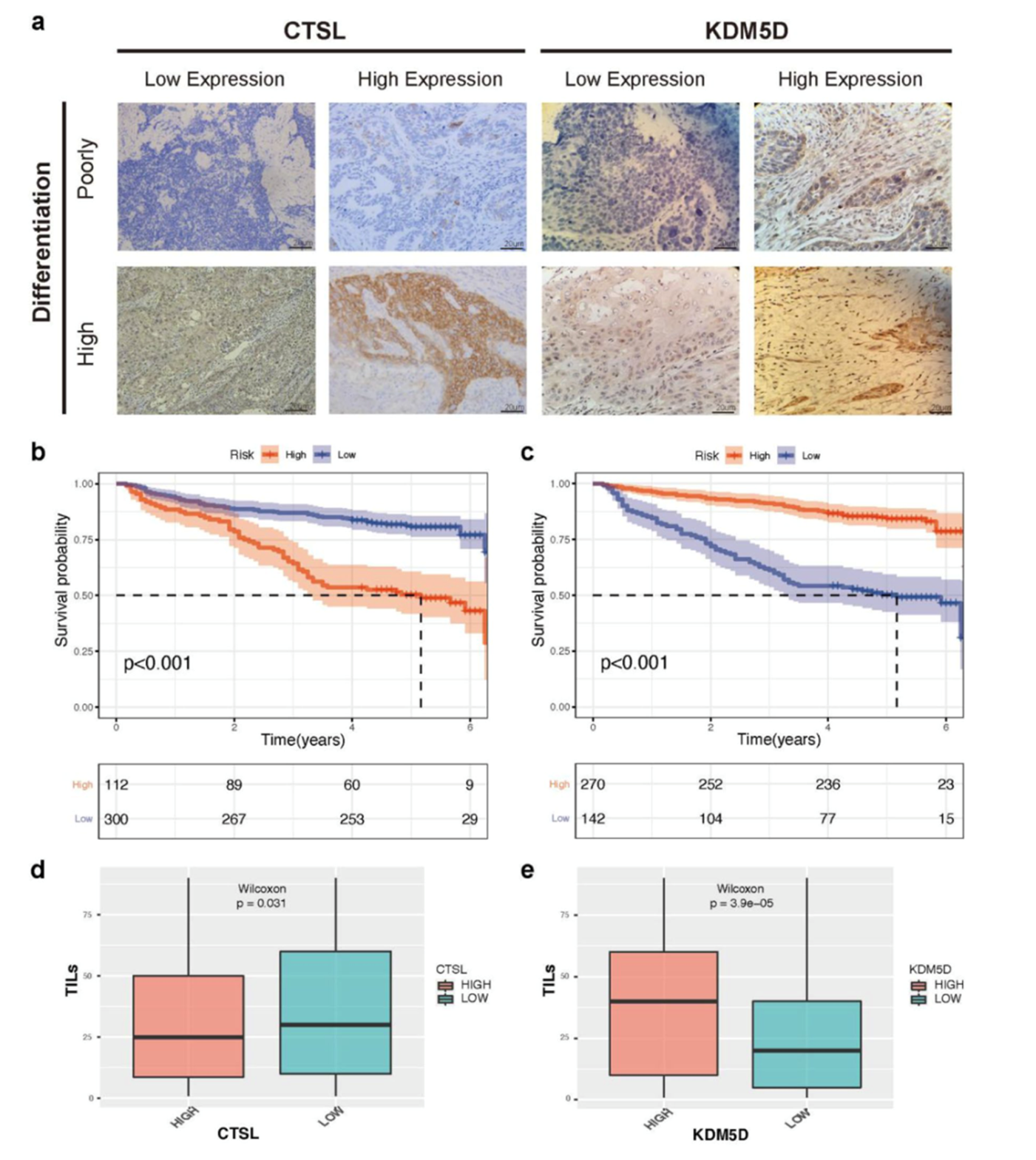
图8免疫组化分析
04
结论
总的来说,作者的研究表明局部肿瘤免疫状态(iTILs,TILv和TILf)和整体免疫状态(PLR)是影响患者生存情况的独立预后因子。作者构建的预后风险模型可以准确预测LSCC患者的预后,鉴定高风险患者并指导个性化治疗。作者的研究鉴定到CTSL和KDM5D基因表达水平与LSCC患者的TILs和预后显著相关。本研究的亮点在于作者使用生信分析与实验验证相结合的方式鉴定到了LSCC患者的预后标志物,然而本研究还需要更大的数据集进行验证。
转载自公众号《生信发文助手》,如有侵权,请联系删除。