大家好!今天给大家介绍一篇2021年12月发表在Briefings in Bioinformatics(IF:11.622)上的文章。作者基于TCGA-LUAD队列的DNA甲基化数据构建iPMS,可以准确预测LUAD患者的免疫表型。
Epigenome signature as an immunophenotype indicator prompts durable clinical immunotherapy benefits in lung adenocarcinoma
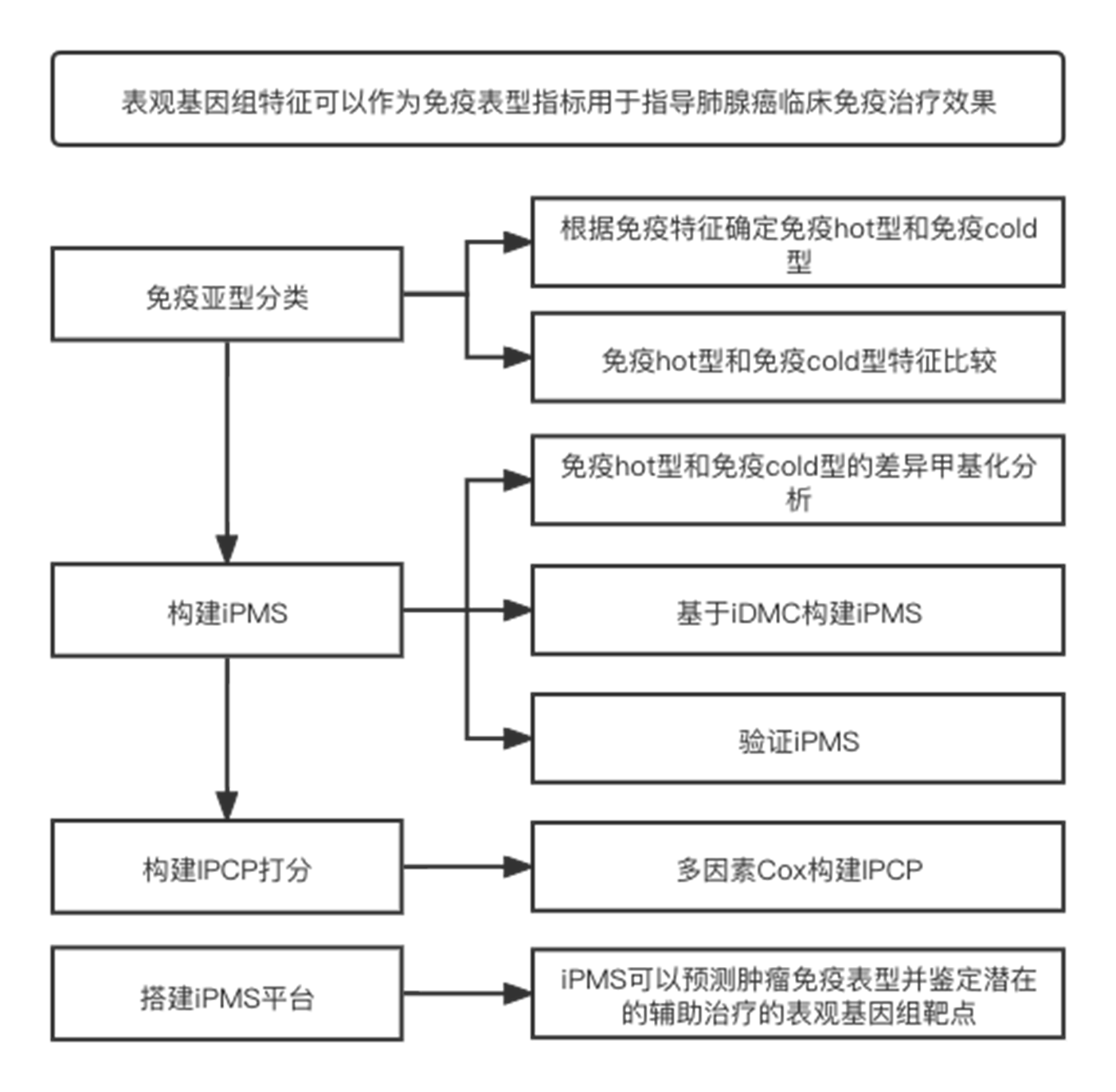
表观基因组特征可以作为免疫表型指标用于指导肺腺癌临床免疫治疗效果
01
摘要
肿瘤的免疫异质性是肺腺癌(LUAD)免疫治疗效果较好的关键原因。肿瘤免疫表型可以用于指导免疫个体差异和潜在的临床治疗。然而,使用表观基因组特征确定肿瘤免疫表型和应答性治疗还不是十分清楚。为阐明肿瘤免疫表型和免疫异质性,作者基于五种免疫表达特征区分LUAD的免疫hot和免疫cold表型。免疫hot型肿瘤的免疫活性更高,疾病分期更低并且生存结果更好。不同免疫表型的DNA甲基化模型与LUAD发展密切相关。作者构建了一个包括5个CpG位点的免疫表型相关的甲基化特征(iPMS),并基于机器学习验证其有效性。此外,作者发现iPMS和免疫表型相关的免疫检查点(IPCPs)可能会增加肿瘤进展的发展,表明IPCP可能作为一种新的免疫治疗阻断靶点。当患者接受抗PD-1/PD-L1免疫治疗后,免疫hot表型的患者生存结果较好,iPMS可以用于预测持久/非持久临床获益。总的来说,本研究阐述了表观基因组在临床肿瘤免疫分型中的作用,利用iPMS表征肿瘤免疫表型。
02
流程图
03
结果
1.数据集获取和下载
从TCGA数据库下载LUAD患者的表达数据和DNA甲基化数从http://bib.oxfordjournals.org/获取验证队列。
2.肿瘤间免疫异质性揭示LUAD免疫表型
作者使用五种免疫表达特征(巨噬细胞,淋巴细胞浸润,IFN-γ反应,TGF-β反应和伤口愈合)描述LUAD肿瘤的免疫活性,基于ssGSEA计算每个患者的iES并对患者浸润一致性聚类,共分为5种免疫亚型(IMC1,IMC2,IMC3,IMC4和IMC5)。此外,作者使用UMAP对五种亚型进行可视化,其中IMC1和IMC2聚到一起,而IMC3,IMC4和IMC5聚到一起(图1A)。随后,作者根据HE染色,TIL,免疫活性和免疫表达特征评估这些免疫亚型的免疫学特征(图1B),其中IMC3,IMC4和IMC5的TIL更多,四种免疫活性打分更高,巨噬细胞和淋巴细胞浸润水平更高(图1B)。因此,IMC1和IMC2为免疫cold型,而IMC3,IMC4和IMC5位免疫hot型。此外,将免疫hot型和免疫cold型富集于四种肿瘤微环境亚型,其中免疫hot型富集于亚型IE和F而免疫cold型富集于亚型D(图1C)。
3.免疫hot型的患者生存结果较好
免疫hot型和免疫cold型的TMB较低(图1D),免疫hot型的非整倍性打分较低(图1E),免疫cold型的整体DNA甲基化水平更低(图1F)。以上结果表明,免疫cold型更类似癌症的分子特征。随后,作者构建Cox回归模型,免疫hot型患者的总生存期较好(图1G),免疫hot型是患者预后的保护因子。
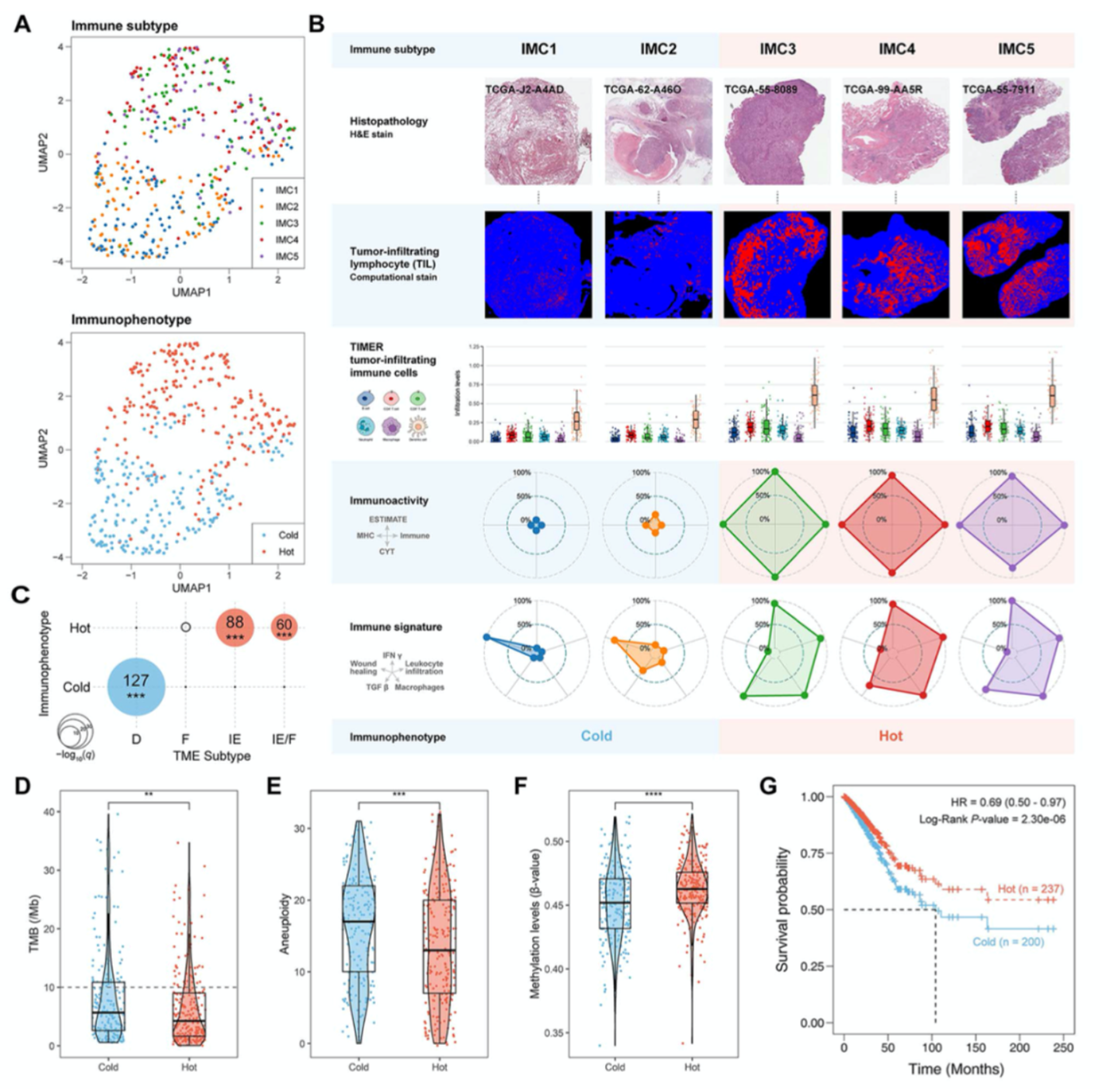
图1 LUAD肿瘤免疫表型的多组学特征
4.免疫表型的表观差异与LUAD发展有关
对免疫hot型和免疫cold型进行差异甲基化分析,鉴定到175个差异甲基化位点(iDMCs)。这些iDMCs显著富集于癌症相关,肺相关和免疫相关特征(图2A)。特别是,一些iDMCs与肺癌风险因子有关,表明iDMCs在LUAD发生中起到重要作用。此外,作者将iDMCs富集于最近的蛋白编码基因(PCGs)中,并计算其相关性。这些iDMCs位于PCGs的转录起始位点(TSS)富集的50kb,在TCGA-LUAD中,66.9%的iDMC-PCG对的甲基化β值与基因表达水平显著相关(图2B),随后对iDMCs相关的PCGs进行富集分析(图2C)。
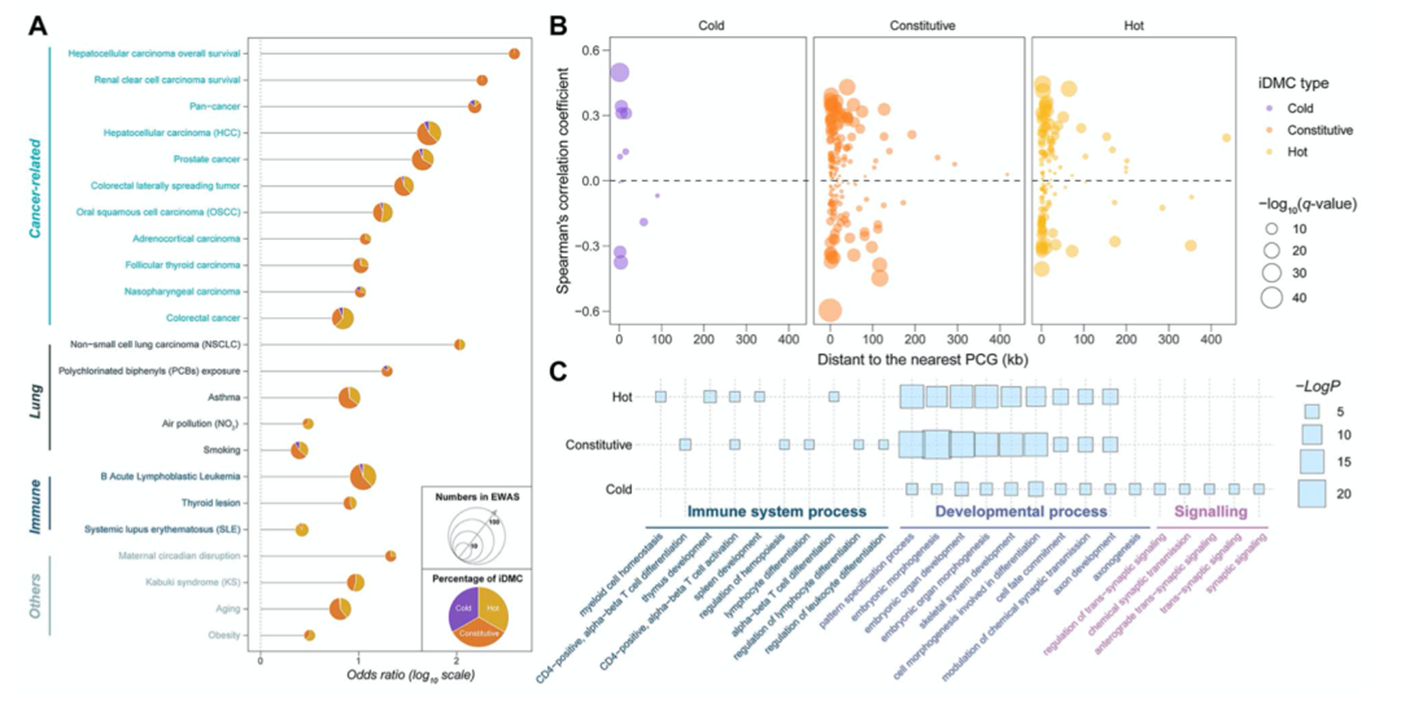
图2免疫表型相关iDMCs与LUAD发展有关
5. DNA甲基化特征可以区分免疫表型
作者使用机器学习算法和TCGA-LUAD数据集构建了于免疫表型相关的DNA甲基化特征iPMS(图3A),iPMS包括5个iDMC位点,这5个iDMC位点都是免疫表型特异性高甲基化(图3B),有4个iDMC位点与免疫特征负相关(图3C)。随后,作者使用反卷积算法构建iPMS打分用于评估患者临床免疫表型。免疫hot型患者的iPMS打分较高(图3D),iPMS预测免疫表型的准确率为81.2%(图3E)。
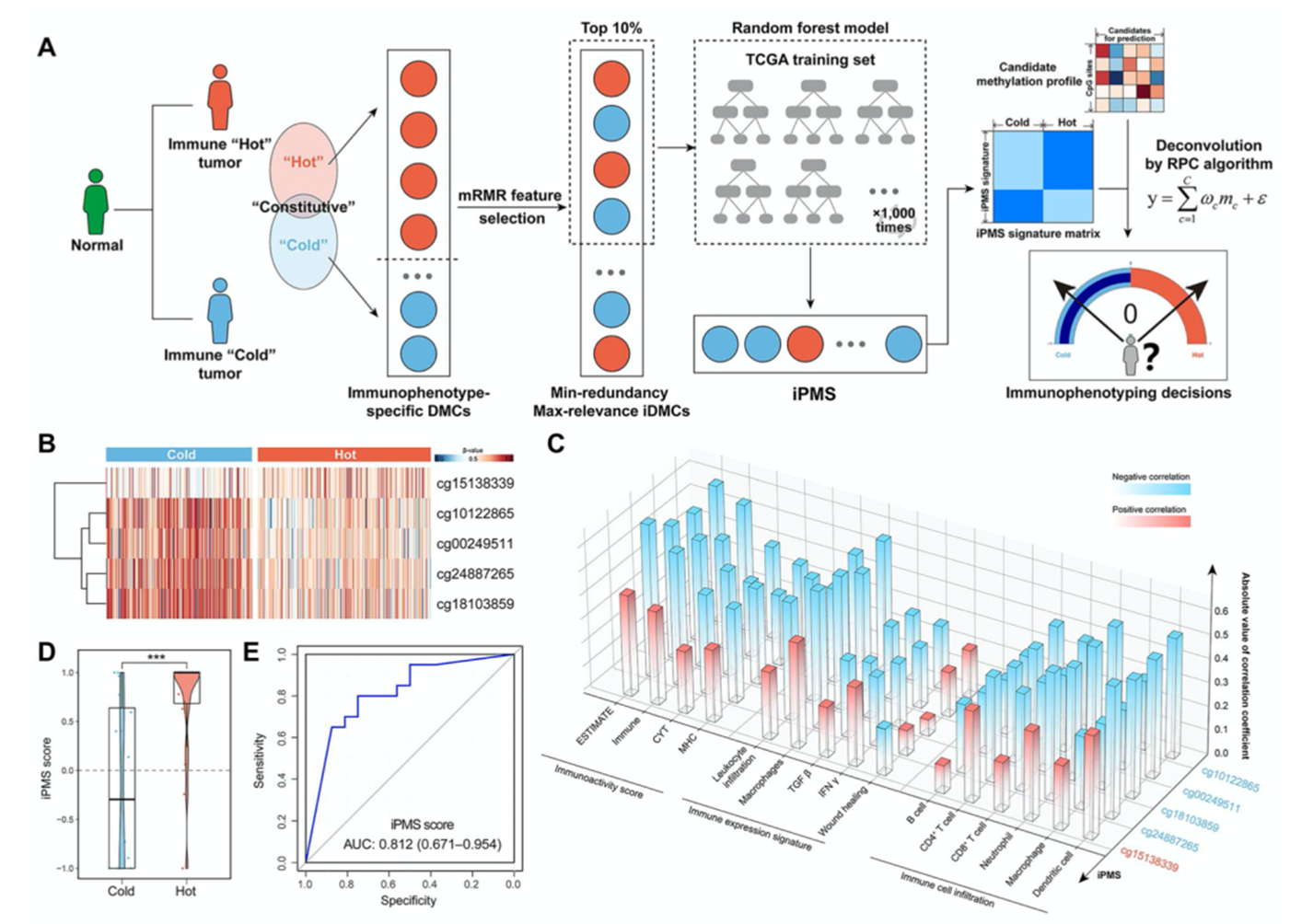
图3 iPMS预测肿瘤免疫表型
6.使用iPMS评估肿瘤免疫表型
为验证iPMS的鲁棒性,作者在5个LUAD独立数据集上验证iPMS打分和免疫细胞浸润水平的相关性。所有数据集的iPMS打分与免疫细胞浸润水平显著相关(图4A),在免疫hot型中CD4+ T细胞,CD8+毒性T淋巴细胞和CD14 +单核细胞的浸润水平较高,表明免疫hot型的免疫活性较强。此外,在蛋白水平上作者使用IHC比较CPTAC LUAD队列的多种免疫细胞标记物的表达水平,免疫hot型的T细胞和巨噬细胞标记物表达水平较高。随后,作者对另外一个GEO数据集进行分析发现免疫cold型的肿瘤尺寸更大,肿瘤尺寸与iPMS打分负相关(图4B)。作者对155名接受辅助化疗的患者进行无复发生存(RFS)分析,免疫hot型的患者化疗效果较好且复发较少(图4C)。将iPMS应用于TCGA放疗队列,免疫hot型患者的生存期较好(图4D)。
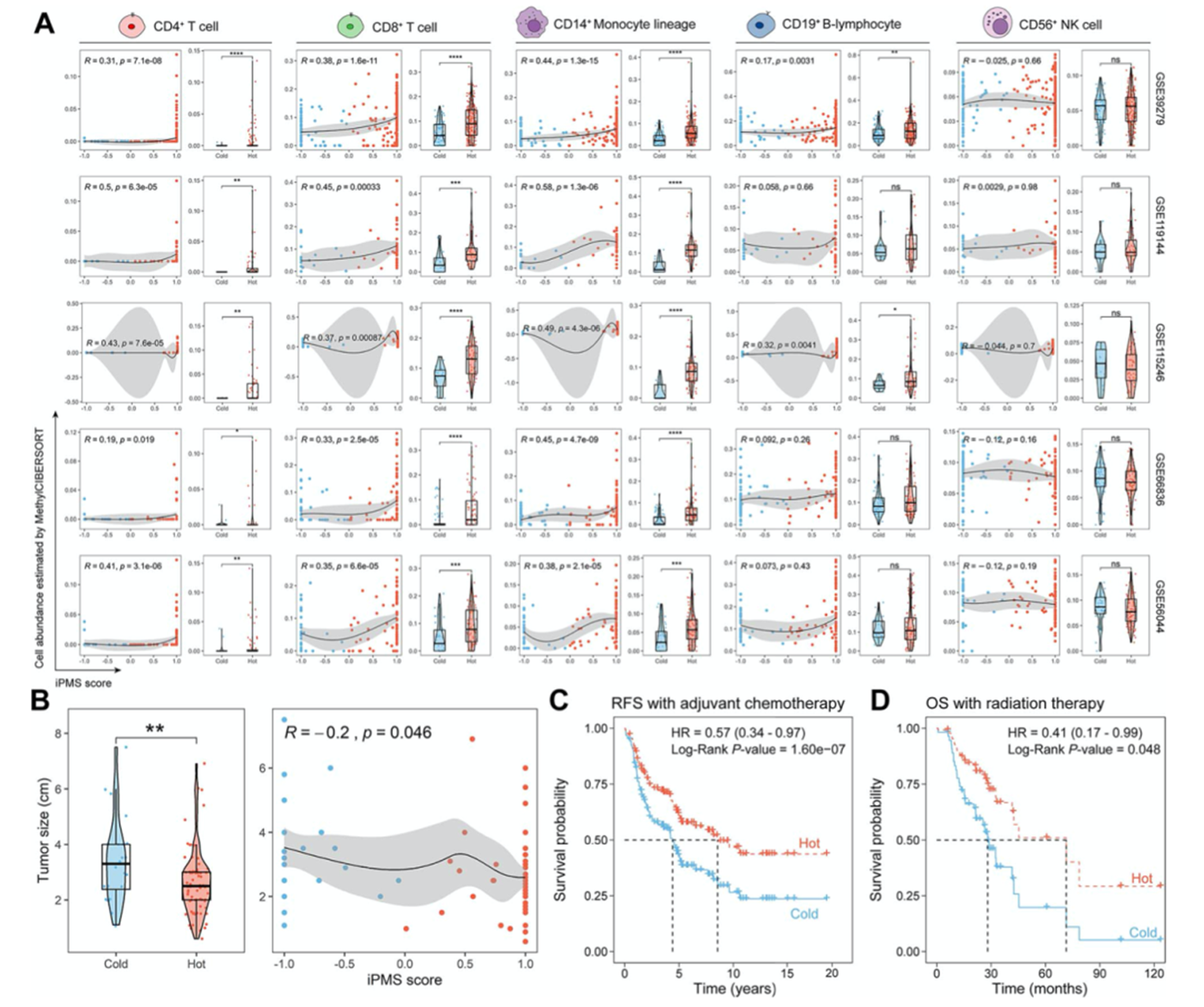
图4 iPMS鲁棒性验证
7.iPMS和免疫表型相关免疫检查点用于预测疾病发展风险
作者鉴定免疫表型特异性ICPs(IPCPs),其特征为免疫表型特异性表达和体细胞突变(图5A),共鉴定到免疫hot型特异性IPCPs和免疫cold型特异性IPCPs。作者使用多因素Cox回归分析研究IPCPs与疾病发展风险之间的关系,IPCPs高风险组患者进展到晚期且iPMS打分结果与之一致(图5B和5C),iPMS打分和IPCP打分显著相关(图5D)。此外,作者构建了IPCP药物互作网络,可以作为免疫治疗的潜在指南(图5E)。
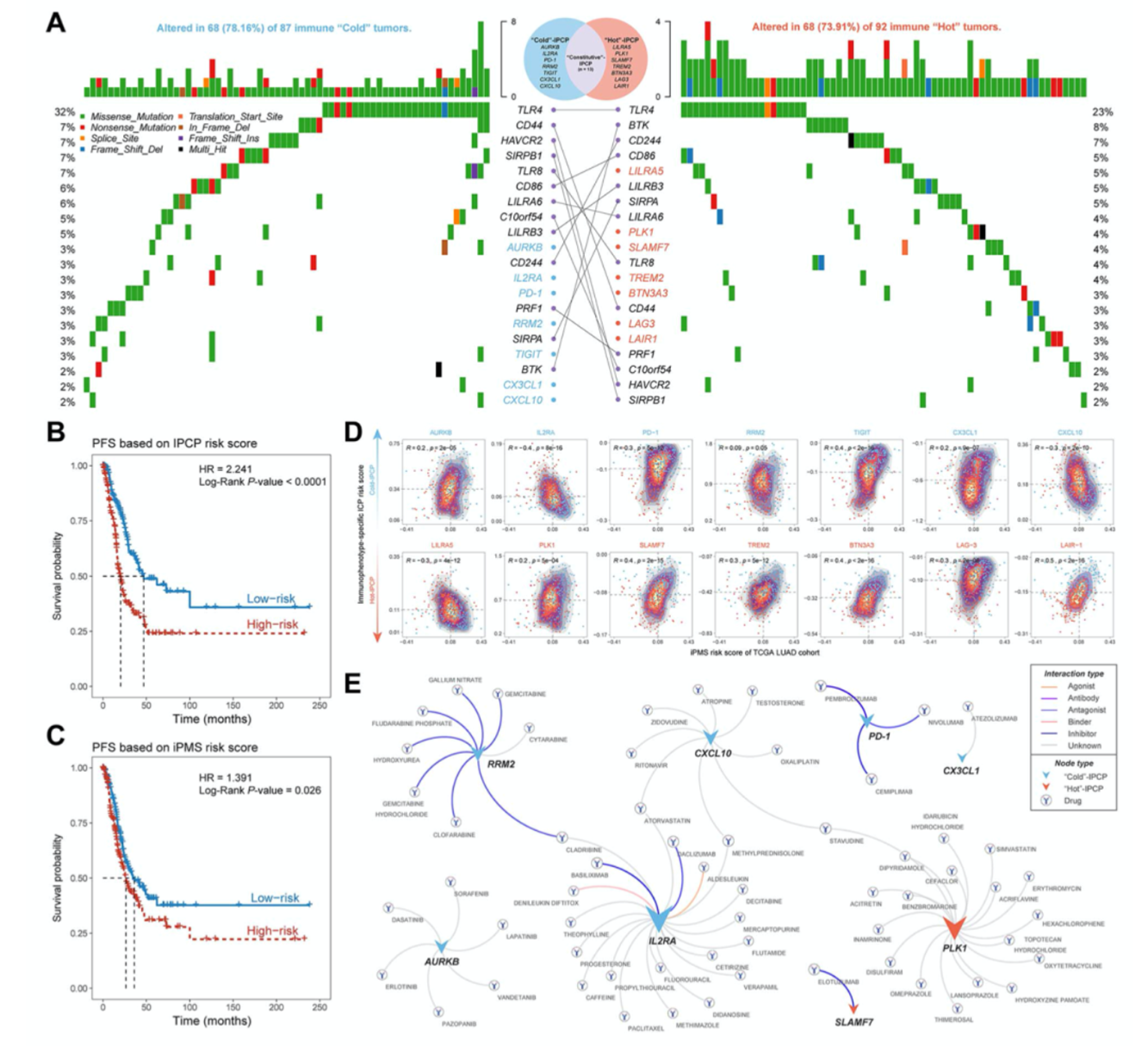
图5免疫表型相关免疫检查点预测疾病发展风险
8.iPMS预测免疫表型表明长期抗PD-1/PD-L1免疫治疗的益处
靶向肿瘤细胞PD-1/PD-L1抗体介导干预可以逆转肿瘤诱导的免疫抑制,诱导T细胞活化,获得持久的临床益处(DCB)(图6A)。免疫hot型肿瘤中CD8 +细胞毒性T细胞丰度与PD-1/PD-L1表达水平的相关性较高(图6B),CD8 +细胞毒性,T细胞浸润水平,溶细胞活性(图6C)和PD-1/PD-L1表达水平较高(图6D)。对接受抗PD-1治疗的患者使用iPMS鉴定免疫表型,其中有11例患者为免疫hot型(图6E)。在DCB和NDB患者中免疫hot型患者的免疫治疗效果较好,疾病进展较慢,表明免疫hot型是免疫治疗的保护因子(图6F)。此外,作者构建iRS描述患者接受免疫治疗疾病进展的风险,免疫hot型的DCB患者风险较低(图6G)。
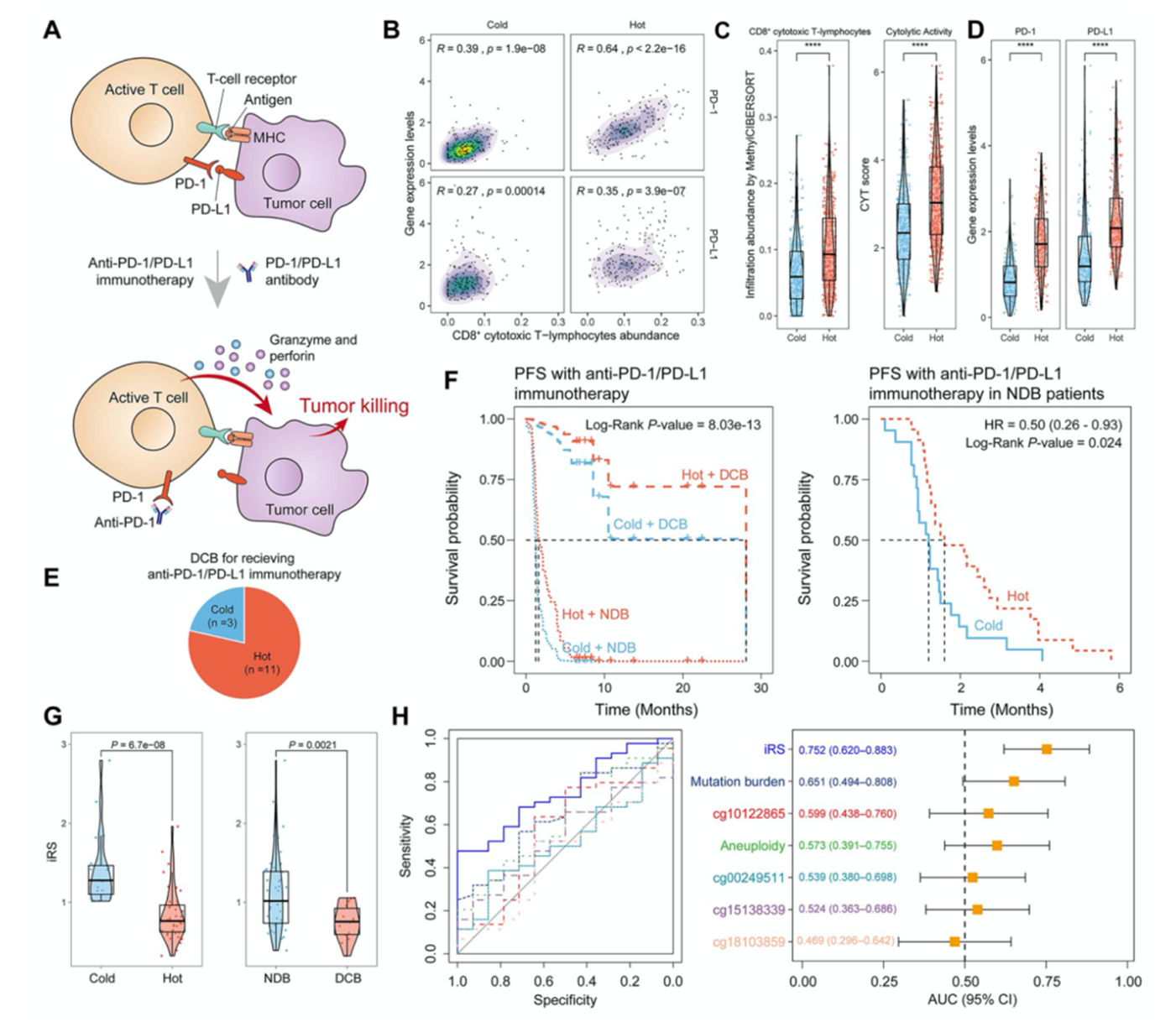
图6免疫表型预测抗PD-1/PD-L1免疫治疗的临床效果
9.iPMIC:研究表观基因组在免疫分型和临床治疗作用的平台
作者开发了一个web平台,可以方便用于上传样本的甲基化数据,iPMIC评估患者的免疫表型和免疫细胞浸润水平并为潜在的辅助化疗,放疗和抗PD-1/PD-L1免疫治疗提供潜在价值(图7A)。此外,作者整合了生存分析工具,用于研究不同免疫表型相关DNA甲基化位点预测化疗(图7B),放疗(图7C)和抗PD-1/PD-L1免疫治疗(图7D)的结果。总的来说,iPMIC可以作为一种有效的工具,可以预测肿瘤免疫表型并鉴定潜在的辅助治疗的表观基因组靶点。
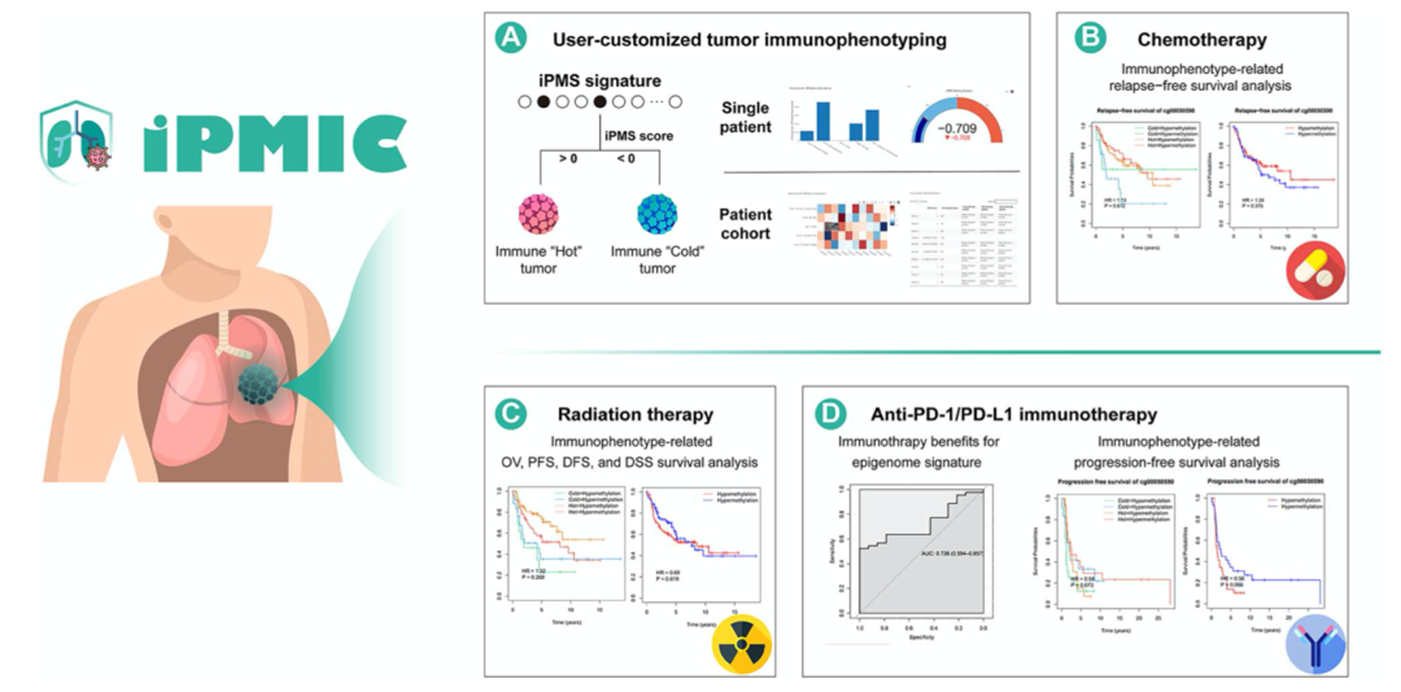
图7构建iPMIC平台
04
结论
总的来说,iPMS在不同免疫细胞浸润水平下预测肿瘤免疫表型均表现出良好的效果。免疫hot型可以作为患者生存结果的保护因子,在辅助化疗,放疗和免疫治疗中均表现出更好的结果。使用iPMS预测肿瘤免疫表型可以促进肿瘤间免疫异质性的特征和LUAD个性化表观遗传治疗发展。本研究的局限性在于本研究纳入分析的样本仍然是一个小样本队列,随着表观基因组数据规模的增长,还需要进一步使用更多的数据进行验证。
转载自公众号《生信发文助手》,如有侵权,请联系删除。