大家好!今天给大家介绍一篇2022年1月发表在Molecular Therapy Oncolytics (IF:7.200)上的一篇文章。本研究通过研究与PD-L1和IFN-γ表达相关的免疫细胞类型鉴定到来源于成纤维细胞的LPP可以作为鉴定预测胃癌患者预后和治疗反应的标志物。
Fibroblast-derived LPP as a biomarker for treatment response and therapeutic target in gastric cancer
来源于成纤维细胞的LPP可以作为胃癌治疗反应和治疗靶点标志物
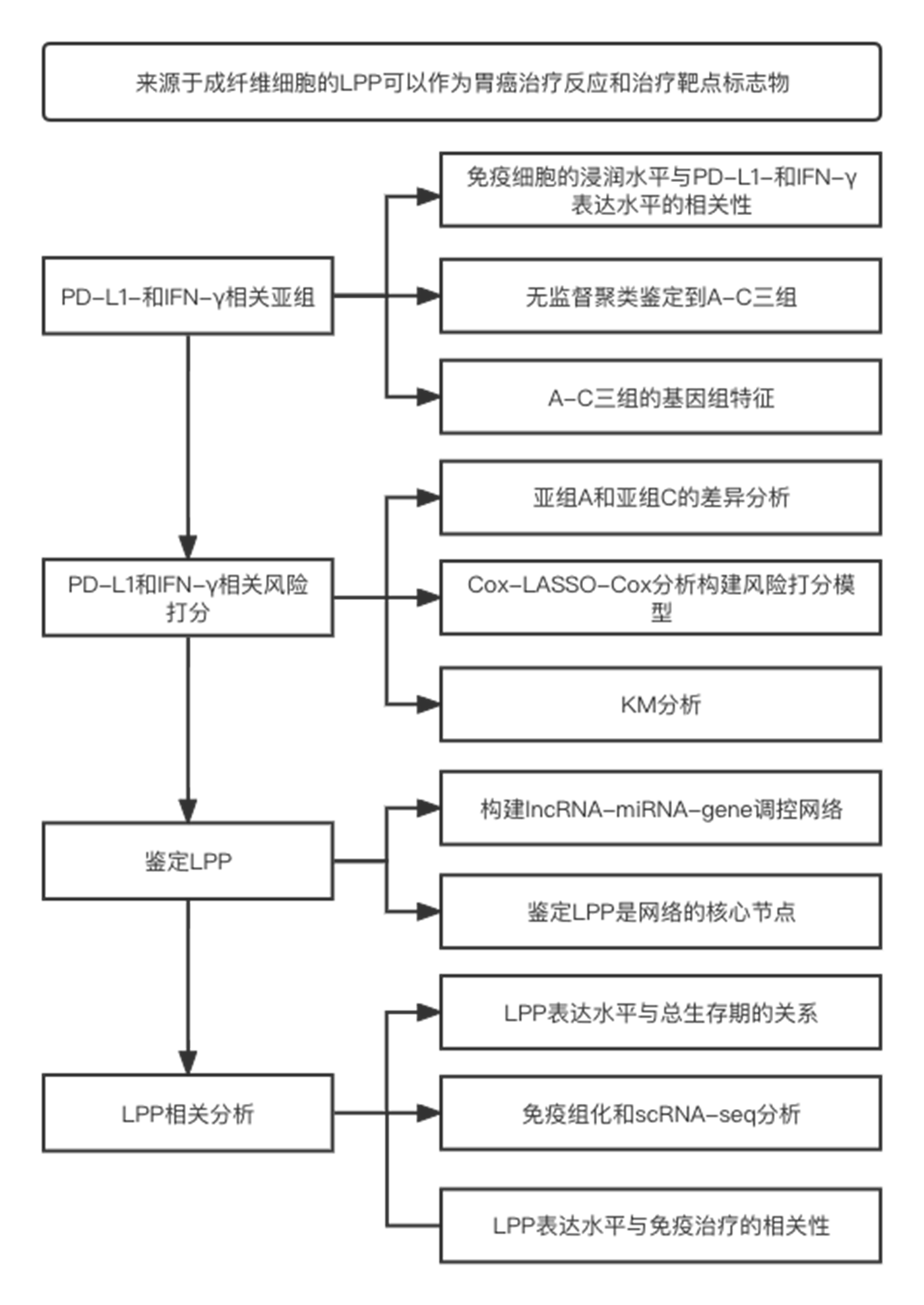
流程图
摘要
肿瘤微环境和免疫检查点的关系对免疫逃逸具有重要意义,会显著影响化疗和免疫治疗效果。本研究旨在鉴定对胃癌治疗耐药的生物标志物和治疗靶点。对多个数据集评估免疫细胞浸润水平并基于与PD-L1和IFN-γ表达相关的免疫细胞鉴定三个患者亚组(A-C)。从亚组A到亚组C患者的预后水平逐渐增加。亚组A的CD4 +记忆T细胞浸润水平显著增加,而亚组C的静息CD4 +记忆T细胞浸润水平显著增加。此外,构建了预测预后的风险打分模型。LPP作为亚组相关调控网络中的核心基因,其表达水平显著上调且与风险打分较高和生存较差有关。生信分析和实验结果表明,成纤维细胞中LPP表达受限且LPP表达与活化的CD4 +记忆T细胞浸润和肿瘤生长有关。此外,LPP低表达患者受益于化疗和免疫治疗。最后,作者鉴定到28个化合物可以作为LPP高表达患者的敏感药物。总的来说,作者鉴定到的LPP可以作为胃癌治疗反应和治疗靶点的生物标志物。
结果
1.数据集的获取和下载
从TCGA数据库获取350例GC患者的转录组数据,体细胞突变数据和生存信息(TCGA-STAD)。从GEO数据库获取GC患者的GSE26899(93例),GSE26901(109例),GSE66229(300例)和GSE28541(40例)数据集,此外GSE29272(268例),GSE62254(300例)和GSE84437(433例)数据集作为验证队列。从TCGA和GTEx数据库获取泛癌种的癌症样本和正常样本的转录组数据集。从Kim和Hugo获取抗PD-1治疗的GC患者(45例)和黑色素瘤患者(26例)的转录组数据集。
2. GC中PD-L1 -和IFN-γ相关亚组
对TCGA-STAD和4个GEO数据集评估22种免疫细胞的浸润水平,其中有7种免疫细胞浸润水平与PD-L1表达水平正相关,有4种免疫细胞浸润水平与PD-L1表达水平负相关(图1A),IFN-γ结果与之类似(图1B)。对与PD-L1和IFN-γ表达水平相关的免疫细胞进行LASSO分析,鉴定到最相关的7种免疫细胞类型,包括静息CD4 +记忆T细胞,活化CD4 +记忆T细胞,T细胞,单核细胞,M1巨噬细胞,静息肥大细胞和中性粒细胞。根据这7种免疫细胞的浸润水平进行无监督聚类分析,共聚为A-C亚组(图1C)。其中亚组A的活化CD4 +记忆T细胞比例较高而亚组C中静息CD4 +记忆T细胞比例较高。从亚组A到亚组C,PD-L1和IFN-γ的表达水平逐渐降低(图1D和1E)。生存分析表明亚组A的预后最差而亚组C的预后最好(图1F)。
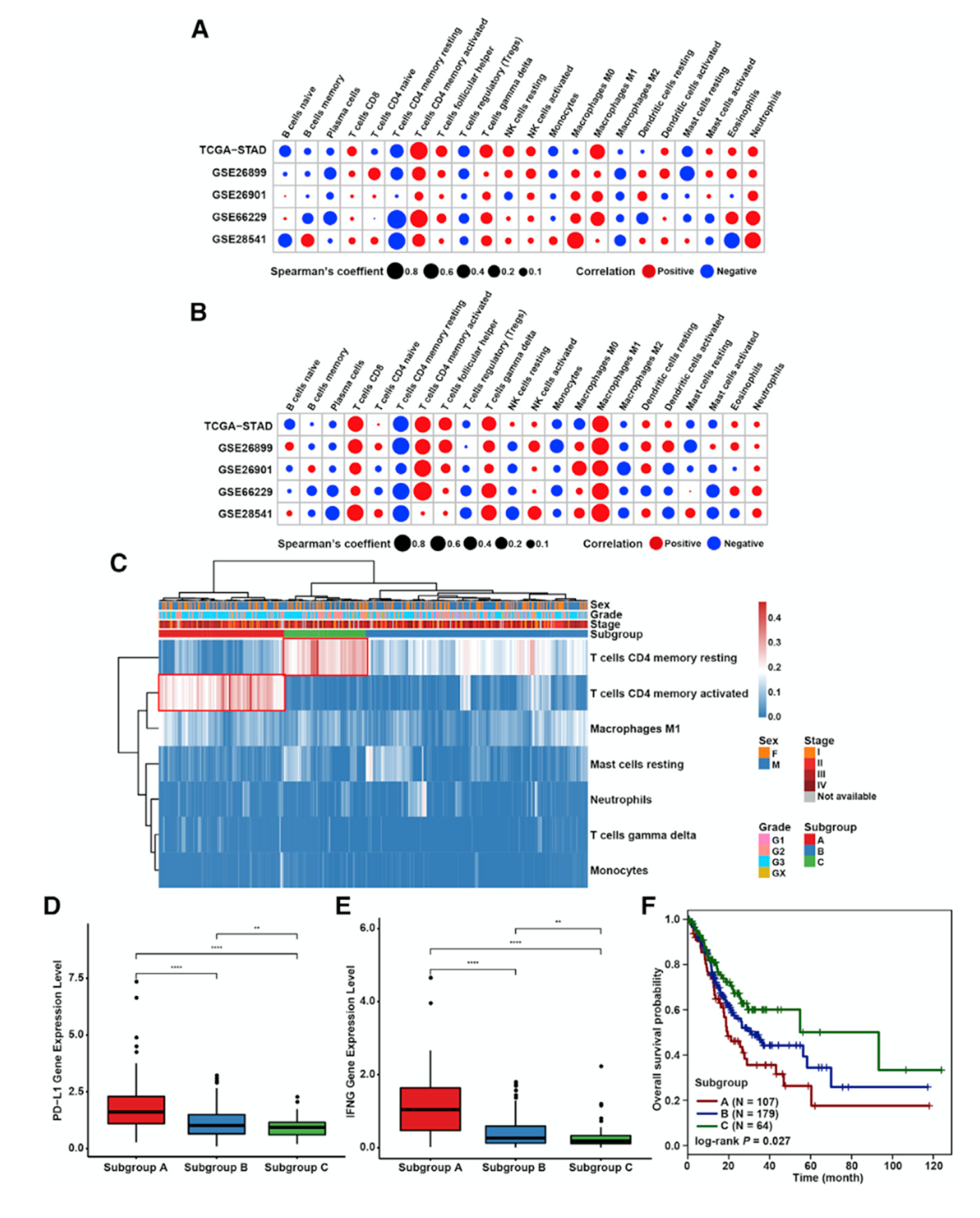
图1 GC中PD-L1 -和IFN-γ相关亚组
3. GC中PD-L1 -和IFN-γ相关亚组的基因组特征
使用TCGA-STAD数据集分析三个亚组的体细胞突变,拷贝数变异和表达水平。不同亚组的TMB显著不同,亚组A的TMB较高而亚组C的TMB较低(图2A)。每个亚组中突变频率最高的10个基因如图2B所示,其中TTN,TP53,MUC16,CSMD3和LRP1B在三个亚组中均发生突变。三个亚组的体细胞突变瀑布图如图2C-2E所示,三个亚组突变共现性如图2F-2H所示。
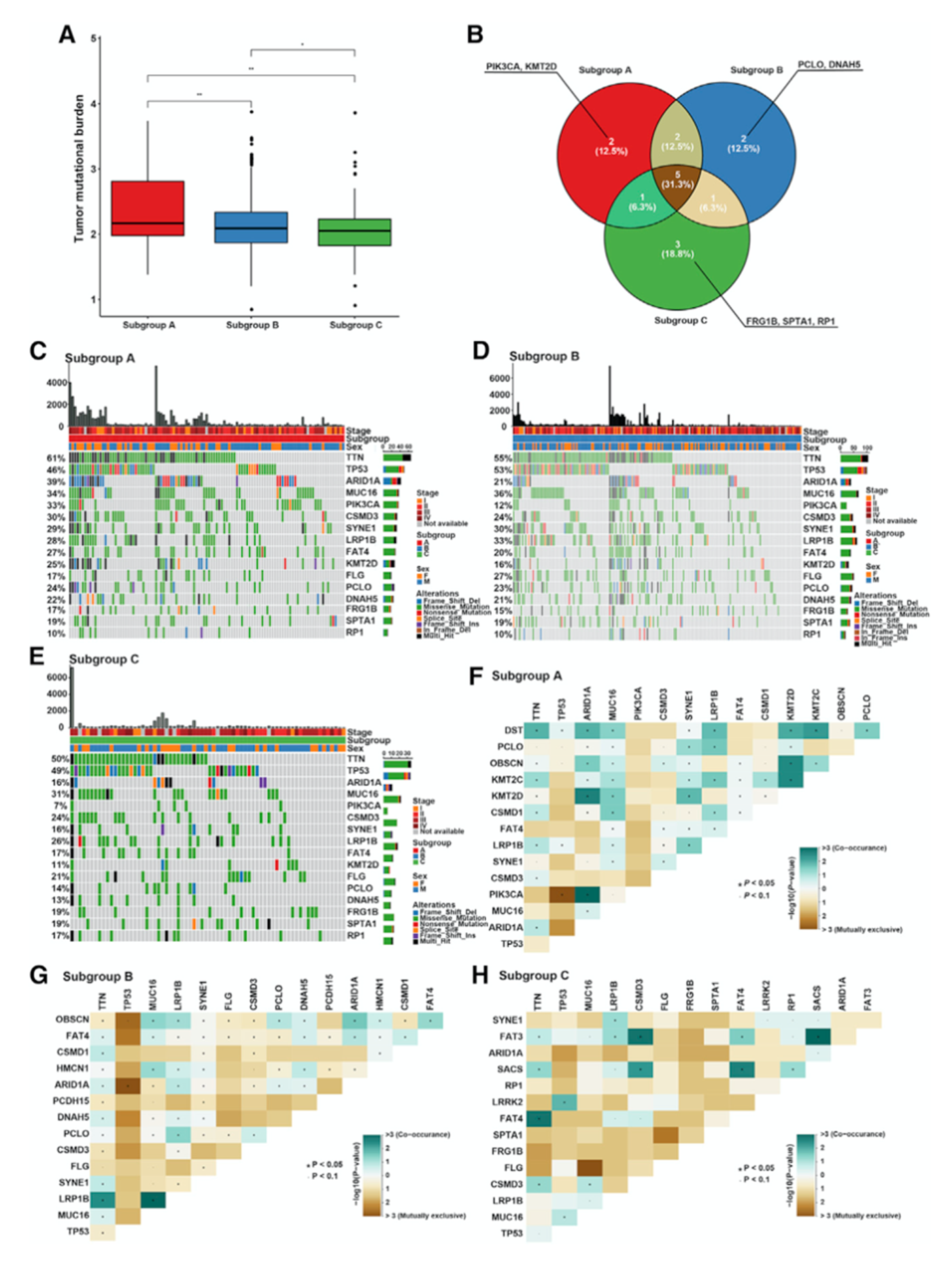
图2三个亚组的体细胞突变图谱
4. PD-L1和IFN-γ相关风险打分对GC预后的影响
对亚组A和亚组C进行差异分析,对差异表达基因进行Cox回归分析和LASSO-Cox分析,最终得到14个基因(图3A)。根据这14个基因的表达水平和相应系数构建风险打分模型。设置阈值为0.5338将患者分为高风险组和低风险组(图3B和3C)。生存分析表明低风险组患者的生存期较长。此外使用独立数据集GSE26899进行验证,结果与之类似(图3D和3E)。
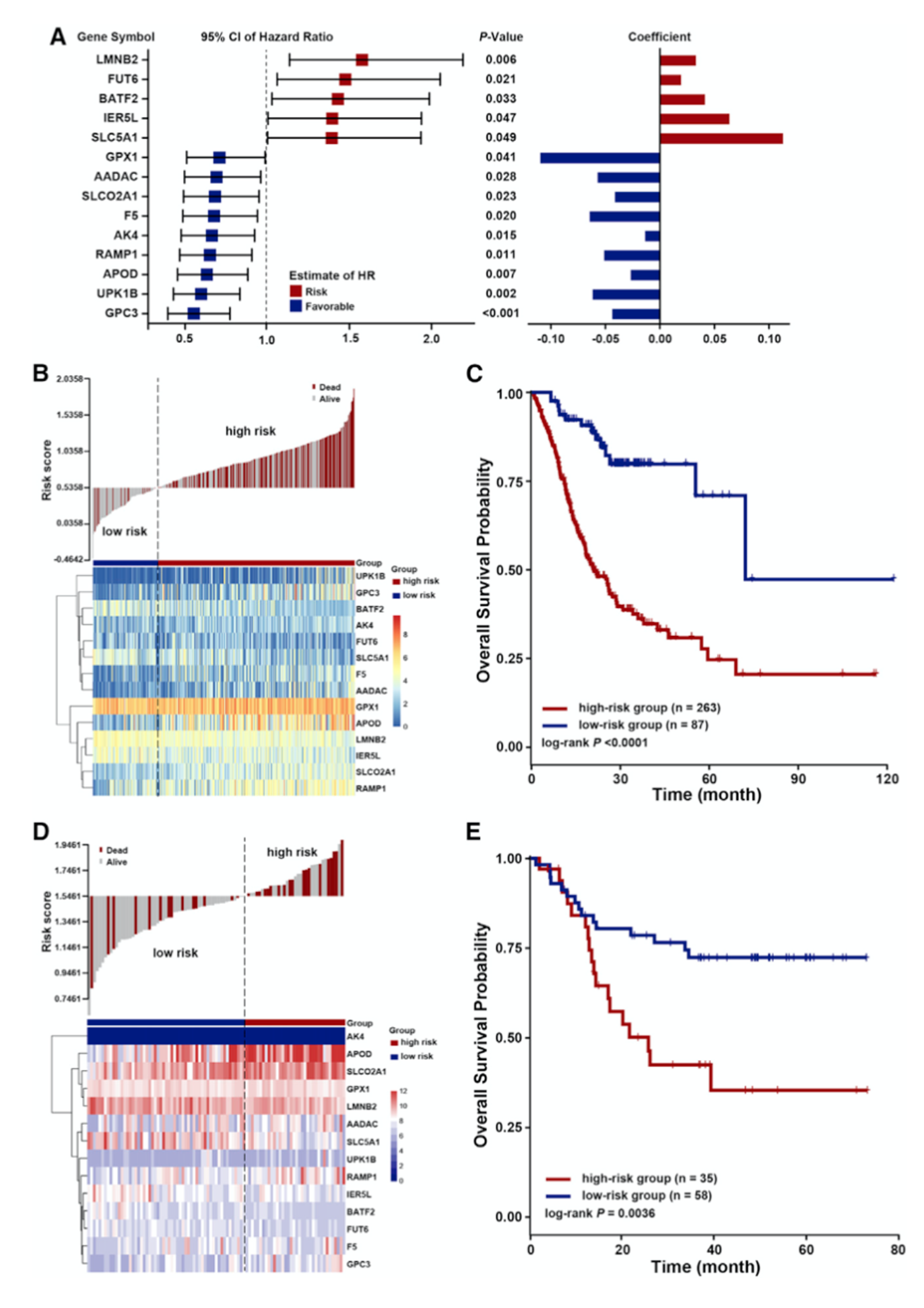
图3用于GC患者预后分层的风险打分
5. LPP是PD-L1和IFN-γ相关的lncRNA-miRNA-gene调控网络的核心节点
对亚组A和亚组C进行差异分析共鉴定到59个差异miRNA和19个差异lncRNA(图4A)。图4B为3个数据库中差异miRNA和基因的调控关系,使用StarBase数据库中lncRNA-miRNA互作关系进行合并,最终得到lncRNA-miRNA-gene调控网络(图4C)。根据网络的拓扑结构鉴定到LPP为该网络的核心节点,LPP的子网络如图4D所示。从亚组A到亚组C,LPP的表达水平逐渐降低(图4E),高风险组中LPP的表达水平较高(图4F)。
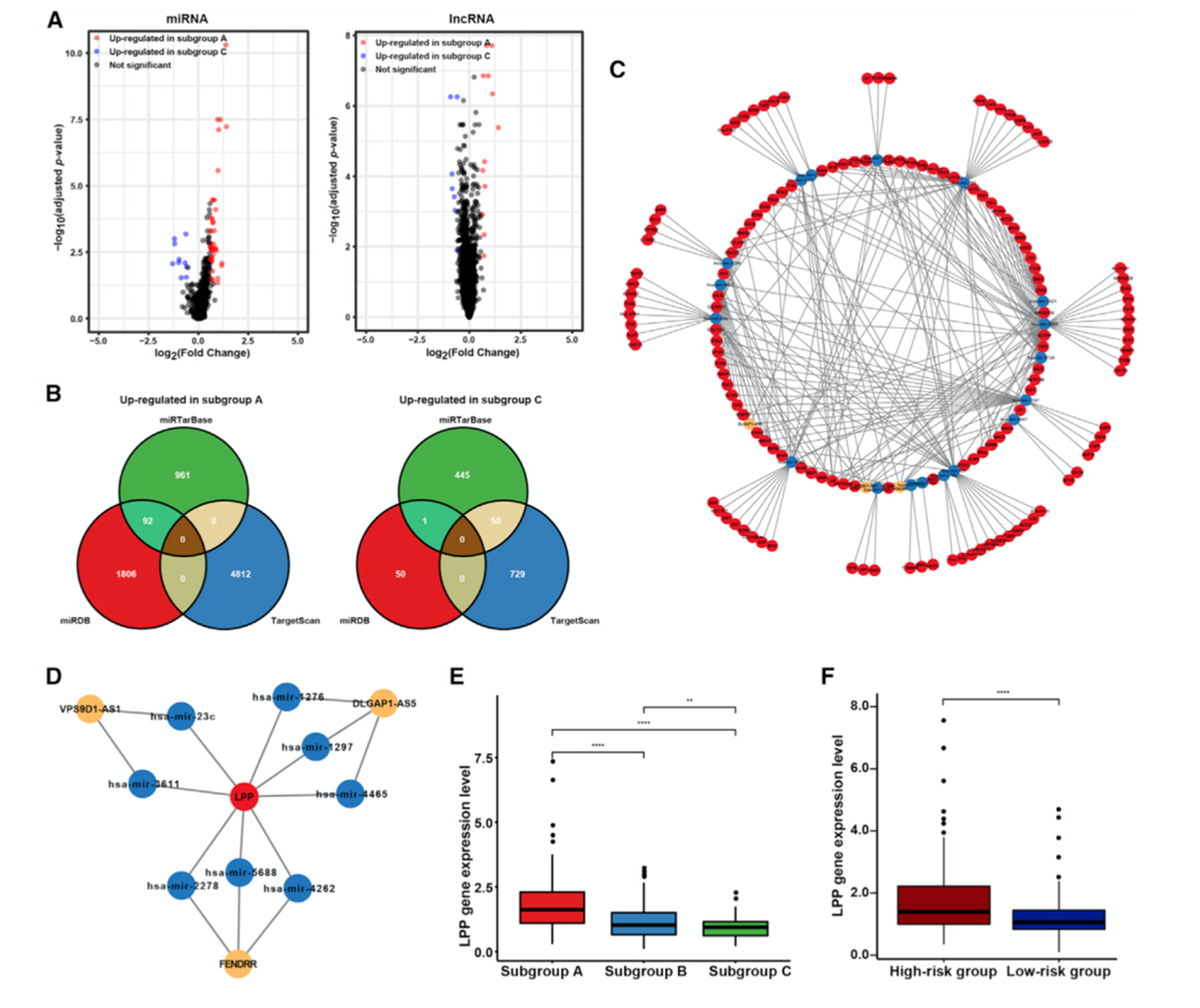
图4 LPP是lncRNA-miRNA-gene调控网络的核心节点
6.高表达LPP可以作为GC预后较差的独立风险因子
LPP在31种癌症组织和相应正常组织中的表达水平如图5A所示,LPP在4种癌症类型中上调表达,在9种癌症类型中下调表达。2个GEO数据集结果与之类似(图5B和5C)。根据最大选择秩检验方法根据LPP表达水平对患者进行分层,将患者分为两组(图5D)。生存分析表明LPP -高组的生存较差而LPP -低组的生存较好(图5E),GSE62254和GSE84437的结果与之类似(图5F和5G)。

图5 LPP高表达与GC预后较差有关
7.来源于成纤维细胞的LPP与胃癌进展和对化疗和免疫治疗的耐药性有关
免疫组化结果表明,LPP在肿瘤组织的成纤维细胞中高表达而在正常组织中几乎不表达,LPP高表达与肿瘤中成纤维细胞浸润水平增加有关。LPP表达水平与6个成纤维细胞的标记物表达水平正相关。此外,作者观察到LPP高表达与活化CD4 +记忆T细胞浸润水平增加和静息CD4 +记忆T细胞浸润水平减少有关。
为进一步研究来源于成纤维细胞的LPP表达水平及在GC中的作用,作者对15例GC样本和相应正常样本进行免疫组化分析。结果表明,LPP蛋白在肿瘤组织中高表达并富集于成纤维细胞中(图6A和6B)。scRNA-seq结果表明,LPP在成纤维细胞中高表达,在干细胞和内皮细胞中表达(图6C和6D)。组织切片染色结果表明LPP蛋白在成纤维细胞中表达(图6E)。为进一步研究LPP在GC发展中的应用,作者构建敲除LPP的成纤维细胞系并用于体内肿瘤生长实验(图6F)。结果表明,敲除LPP的小鼠肿瘤体积更小(图6G和6H)。这些结果表明来源于成纤维细胞的LPP与GC肿瘤发展有关。
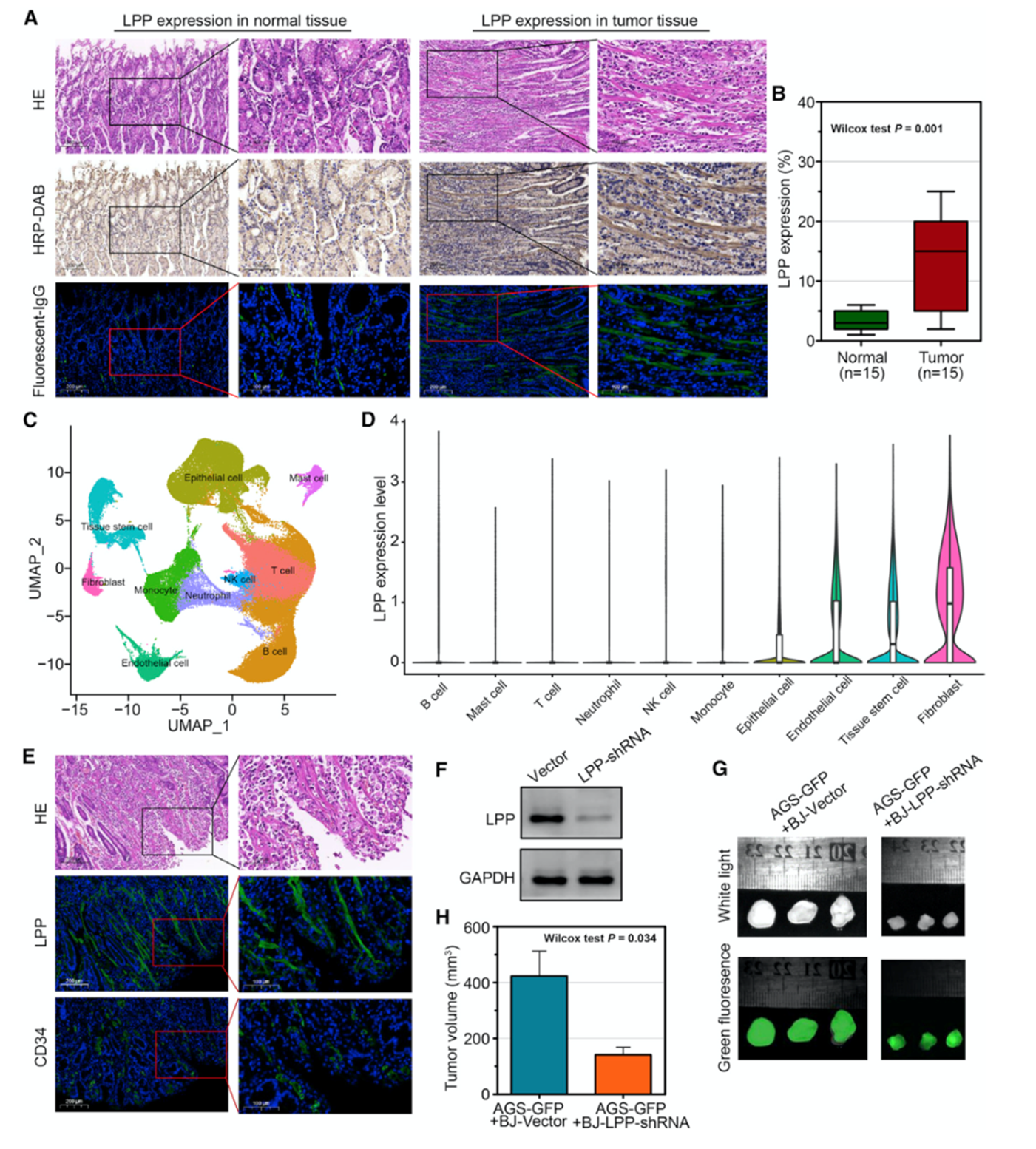
图6来源于成纤维细胞的LPP参与GC发展
为研究来源于成纤维细胞的LPP对化疗反应的影响,作者使用TCGA-STAD数据集评估GDSC数据库中四种化疗复合物的IC50。结果表达,LPP高表达患者的四种化疗复合物的IC50值较高,表明LPP高表达患者对化疗的敏感性较低(图7A-7D)。GSE62254数据集结果表明,无论是否接受化疗,LPP高表达患者的总生存期较差(图7E-7H)。总的来说,LPP高表达患者对化疗反应较差。
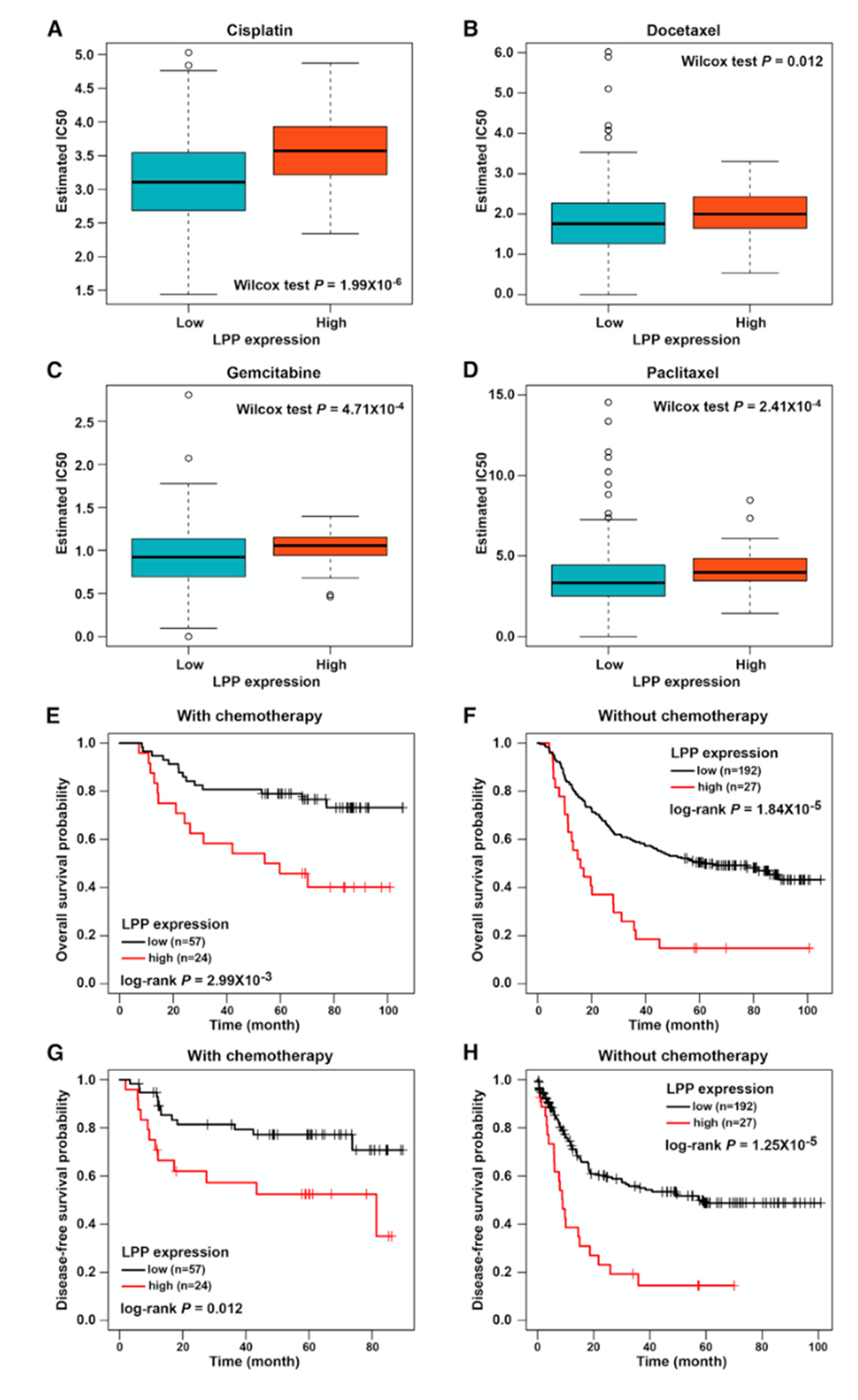
图7 LPP高表达患者更难受益于化疗
对接受抗PD-1治疗患者的数据集进行分析,结果表明在有反应组中LPP的表达水平较低(图8A和8B),LPP高表达患者的治疗有效率较低(图8C)。Hugo数据集结果与之类似(图8D-8F)。使用TIDE打分预测TCGA-STAD数据集对免疫治疗的反应,LPP高表达组的TIDE打分较高(图8G),根据TIDE打分将患者分为应答组和非应答组(图8H),LPP高表达组的应答率较低(图8I)。结果表明,LPP高表达可能会导致GC患者的肿瘤免疫逃逸和免疫治疗耐药性。
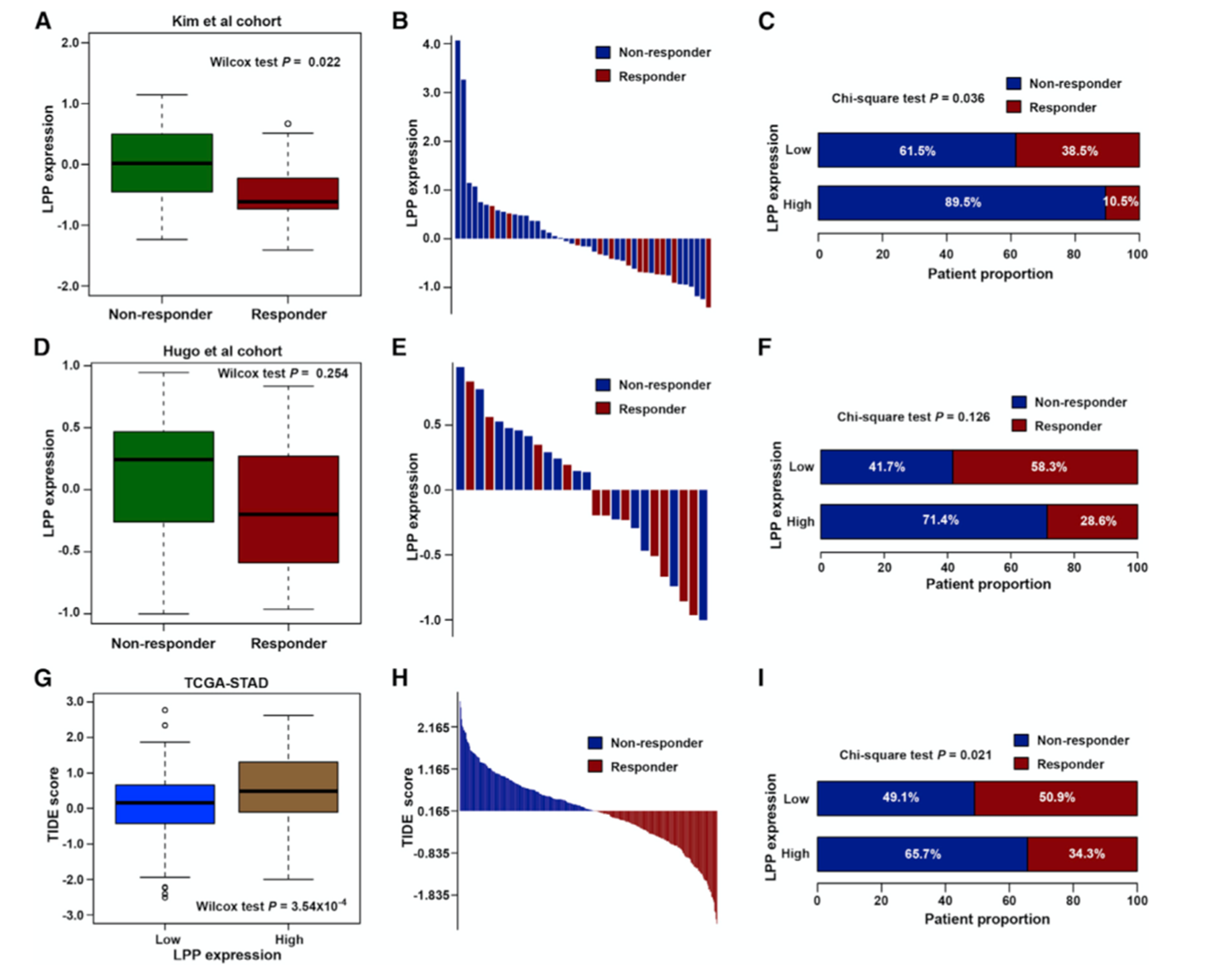
图8 LPP高表达与免疫治疗耐药性有关
8.潜在化合物对LPP高表达患者的敏感性
使用GDSC数据库研究对LPP高表达患者敏感的潜在化合物。根据TCGA-STAD数据集中138个化合物的IC50值鉴定到28个化合物是LPP高表达患者的敏感药物。这些化合物靶向参数肿瘤发生相关通路。
结论
总的来说,作者通过研究PD-L1和IFN-γ表达水平与肿瘤微环境的关系,最终鉴定到来源于成纤维细胞的LPP可以作为化疗和免疫治疗反应的有效预测因子。作者的结果表明LPP是预后不良和独立危险因素,LPP高表达患者不能受益于化疗和免疫治疗。最后,作者鉴定到28个化合物可以作为LPP高表达患者的潜在敏感药物。然而,本研究还存在一定局限性,例如尽管本研究分析了22种免疫细胞的浸润水平和状态但是仍然忽略了一些可能参与GC患者免疫微环境的免疫细胞类型。
转载自公众号《生信发文助手》,如有侵权,请联系删除。