本文由医信融合团队成员“陈浩然”撰写,已同步至微信公众号“医信融合创新沙龙”与“研究生学生信”,更多精彩内容欢迎关注!



Article name:Hypoxia and HIF-1 as key regulators of gut microbiota and host interaction.
Journal:Trend in Immunology
Doi:https://doi.org/10.1016/j.it.2021.05.004
IF:16.687
当前浏览器不支持播放音乐或语音,请在微信或其他浏览器中播放没有理想的人不伤心音乐:新裤子-生命因你而火热


本文主要是记录在综述中反复出现的概念,以及基础知识,在原文基础上进行一定的整理和归纳
1
缺氧诱导因子(HIF)在缺氧中的作用
1. O2的两面性
• O2的积极作用
在细胞水平上,有一些系统可以感知并响应O2浓度的变化,这是多细胞生物有氧呼吸的重要因素,其中,常见的传感器就有HIF
• O2的消极作用
O2转化为活性氧(ROS),对细胞产生有害影响
2. HIF的影响因素
• HIF-α的稳定性
HIF-α受O2调节蛋白的调节,包括脯氨酰羟化酶(PHD)和抑制因子HIF (factor inhibit HIF , FIH)
• 反式激活的调节
3. HIF-α亚基的三种同工型
HIF-1α、HIF-2α和HIF-3α。这些同工型[1]转移到细胞核,与组成型表达[2]的β亚基一起形成复合物,并调节影响关键细胞通路的基因的表达,包括代谢和自噬。
4. HIF反应的复杂性
各种因素导致HIF反应的复杂性,包括它们也可以通过O2独立机制被激活,并且它们是细胞特异性的。
5.缺氧机制与HIF激活的关系
尽管HIF激活是支持缺氧反应的研究最多的机制,但它并不是唯一涉及的机制。最近的一项研究使用了人类基因敲除(KO) K562细胞的全基因组库,这些细胞暴露于1%、5%或21%O2中,并分析了给定基因KO的逐渐消耗或积累。使用这种方法,作者发现了**数百个与缺氧和常氧相关的基因**。典型的缺氧通路在短期(3天时间点)内得到调节,但**被认为在较长时间的缺氧条件下对缺氧适应性不是必需的。因此,对缺氧的反应似乎比以前预期的更复杂,因为它们也可能涉及HIF非依赖性机制:是细胞特异性的,并且在组织缺氧的急性和慢性期可能发挥不同的作用**。
2
图解哺乳动物的肠道缺氧
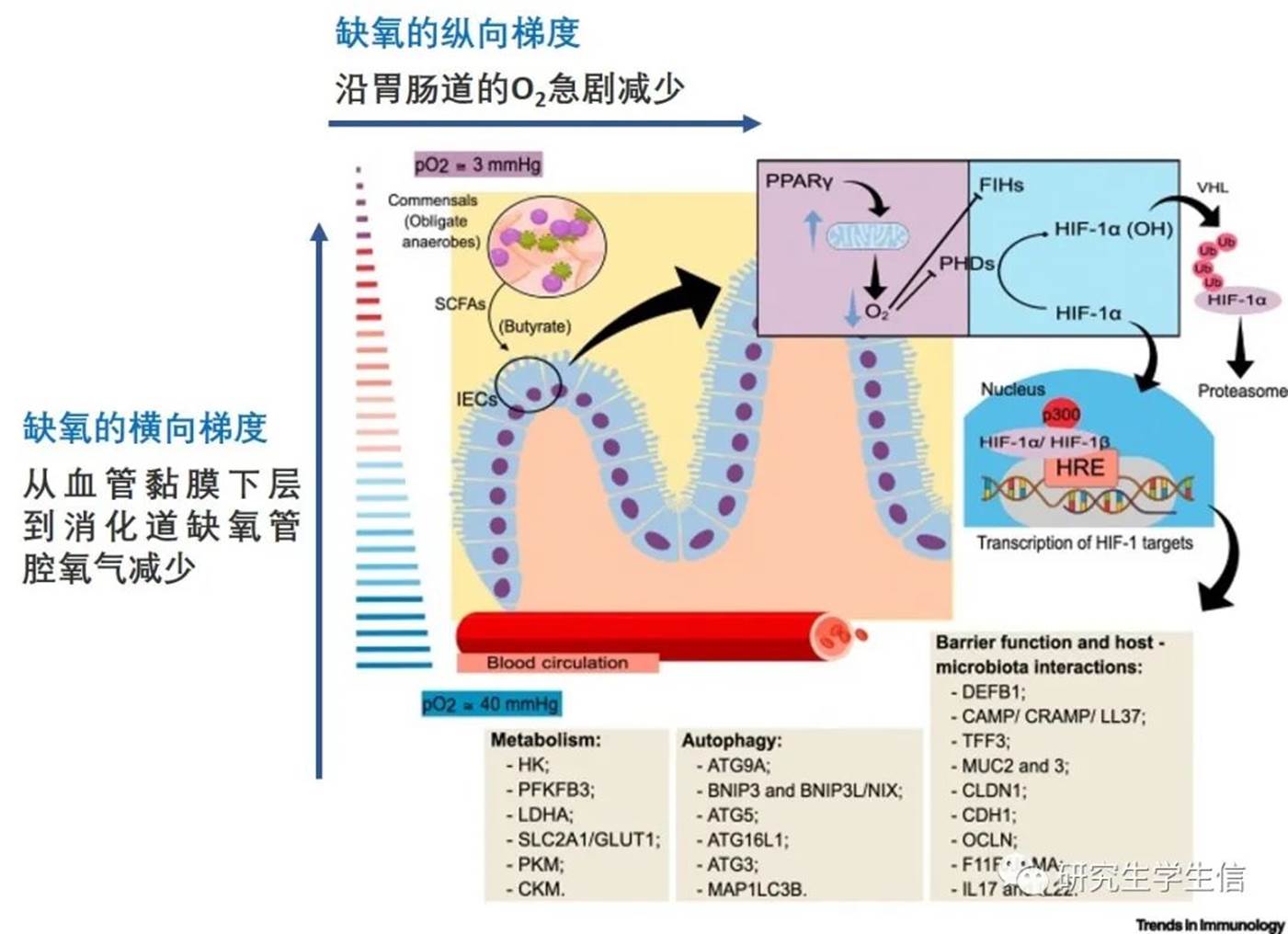
Fig 1
1.肠道缺氧环境下相关蛋白调控关系
肠道的低氧环境可以诱导肠上皮细胞(IECs)中几种HIF-1靶基因的表达,从而影响其代谢、屏障功能和生存。肠腔的特点是氧气利用率低。生理性缺氧部分是由肠道微生物群产生短链脂肪酸(SCFA)来维持的,这些代谢物,特别是丁酸盐(butyrate),调节IECs上的几种信号通路,包括过氧化物酶体增殖物激活受体γ(PPARγ)的激活,通过该信号增强线粒体的β氧化[3],促进氧的消耗。可利用的氧气含量降低会抑制脯氨酰羟化酶(PHD)和抑制因子HIF (FIH),减少HIF-1α的降解并使其易位至细胞核。一旦进入细胞核,HIF-1α与HIF-1β和p300形成复合物,并增加几个基因的转录。与细胞代谢适应(即诱导从氧化代谢到糖酵解代谢的转变)和各种过程(包括屏障功能和自噬)相关的基因属于HIF-1靶基因列表(Fig1中方框部分为例),并且这些基因在适应肠上皮细胞适应低氧环境中起着重要作用。
补充
1. 上面提到了PPAR**信号通路和**HIF-1α**的关系,因此查找相关文献作为知识补充(Fig 2),可以看出**PPAR与HIF-1存**在空间邻近介导的协同转录诱导关系。**
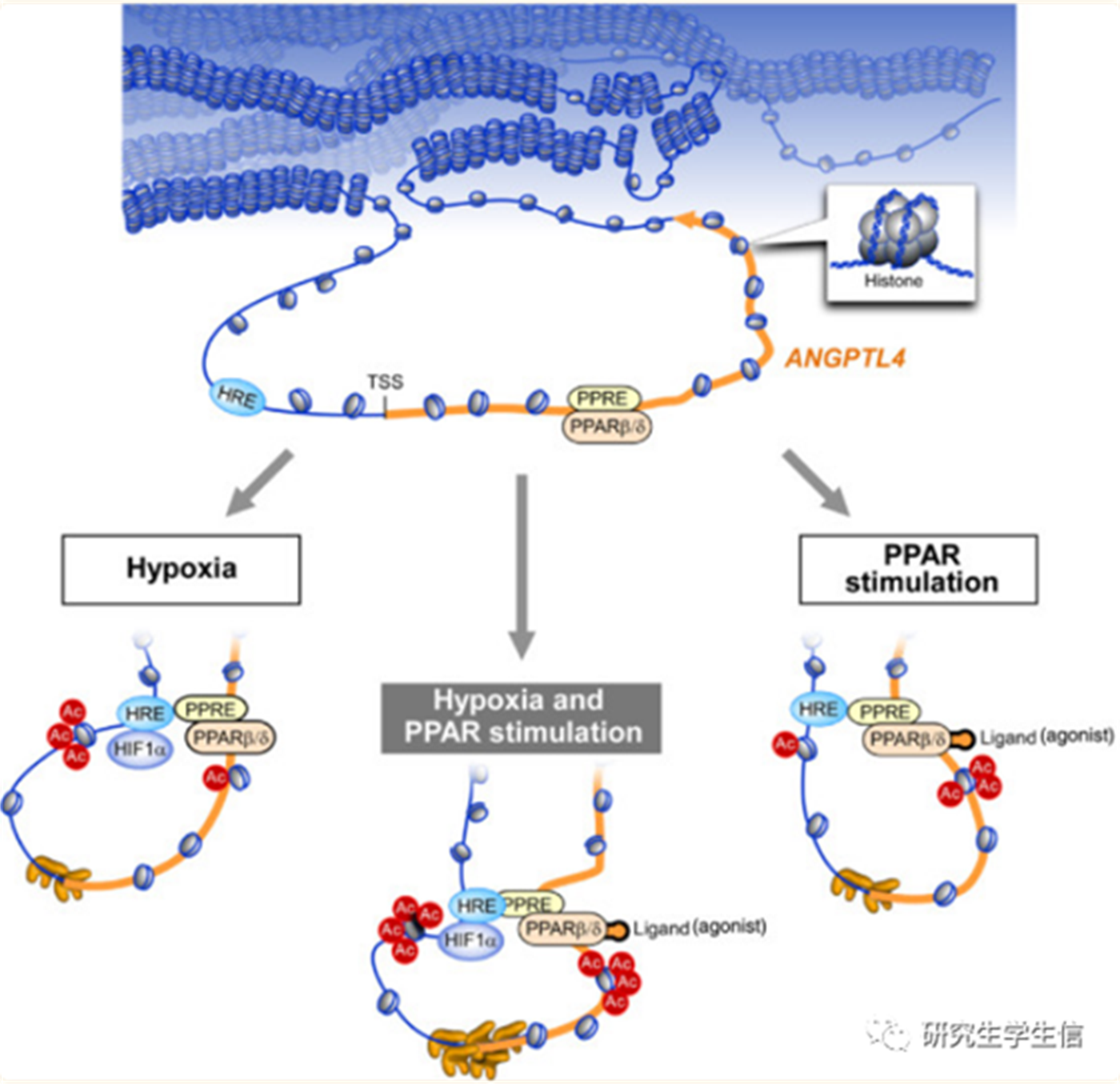
Inoue T, Kohro T, Tanaka T, et al. Cross-enhancement of ANGPTL4 transcription by HIF1 alpha and PPAR beta/delta is the result of the conformational proximity of two response elements. Genome Biol. 2014;15(4):R63. Published 2014 Apr 10. doi:10.1186/gb-2014-15-4-r63
Fig 2.(染色体)空间邻近介导的协同转录诱导示意图。上半部分显示了ANGPTL4基因座,包括HRE(缺氧反应元件)、TSS和PPRE。PPARβ/δ在刺激前位于PPRE(PPAR反应元件)。左:在缺氧条件下,乙酰转移酶通过HIF1α与HRE结合而接近HRE基因座。ANGPTL4假设一个循环形成,以使HRE更接近PPRE。虽然PPRE不是HIF1α的直接靶标,但这种构象会导致PPRE乙酰化。右:在PPAR配体(激动剂)刺激下,PPARβ/δ的位置没有改变,但它被化学修饰为活性形式。据推测,由于PPAR的辅因子,PPRE更接近HRE,导致HRE乙酰化。中:在双重刺激下,HRE和PPRE彼此靠近,导致两个区域的附加乙酰化,并且可能在TSS上加载更多的Pol II,可能导致协同转录激活和串扰。
2. 对于生信分析来说,仍需进一步明确PPAR信号通路与HIF-1信号通路的调控关系以及相关作用上下游基因
2.肠道缺氧环境的特征
1. 氧气含量的横向梯度与纵向梯度(见Fig1)
2. 肠道O2环境(稳态)由两个过程导致:(i)血流氧合;(ii)宿主细胞和微生物群成分消耗的O2
3. 肠道氧气环境发生改变时,微生物群分布也会作出相应改变
4. IEC提供了物理和化学屏障来隔离微生物群并保护有机体免受病原体的侵害
3
**宿主-微生物群相互作用可以维持肠道缺氧**
维持肠道生理性缺氧的循环:共生厌氧菌释放代谢物(如SCFA),IEC使用这些代谢物通过线粒体呼吸产生ATP,线粒体呼吸是消耗环境中氧气的过程。从这个意义上说,干扰微生物群组成或上皮代谢的条件(例如抗生素或低纤维饮食)会损害这种互利的相互作用,破坏缺氧并有利于病原体定植。
4
缺氧介导的IEC调节:HIF-1和SCFA的作用
• 在IEC中HIF-1α缺乏的小鼠与野生型相比,上皮屏障功能障碍,通透性增加,循环脂多糖(LPS)浓度和肝大肠杆菌蛋白更高。
• 在艰难梭菌感染(CDI)的单独小鼠模型中,CDI是一种产毒革兰氏阳性厌氧菌,可导致严重的肠道损伤和炎症,HIF-1被证明是丁酸盐对肠上皮细胞的保护作用中所必需的。
• 与WT小鼠相比,HIF-1缺陷小鼠在用丁酸盐治疗时,在CDI感染后表现出较差的临床得分,细菌或FITC -葡聚糖(用于测量肠道通透性)易位没有变化。
• 口服抗生素因其对微生物群定植抗性(抵抗病原体定殖的能力)的负面作用而成为CDI的主要危险因素之一
• 从这个意义上说,恢复抗生素治疗小鼠结肠中丁酸盐浓度的策略,例如口服丁酸盐或高纤维饮食,保护动物免受CDI的影响,相对于模拟治疗的动物或接受常规饮食的小鼠,显著降低了疾病强度。
• HIF-1在Caco-2细胞中的染色质免疫沉淀(ChIP)表明HIF-1可以结合多种自噬相关基因(如ATG9A)
• ATG9A可以确定IEC中粘附连接和紧密连接的定位。
• T84细胞(人结肠腺癌肺转移细胞)中,在缺氧条件下培养时,这种肠道屏障功能可以得到改善。即:与常氧条件下培养的细胞相比,观察到跨上皮阻力的增加以及紧密连接相关基因表达的上调。
• 当通过T84细胞中的shRNA敲除HIF-1α时,缺氧引起的变化(IEC粘附连接和紧密连接)被消除......(上皮HIF-1对黏膜愈合的重要性)
• 粘液层和抗菌肽(AMP)的产生也受到缺氧和HIF-1的调节
• 总的来说,以上研究通过增强紧密连接和降低肠道通透性,以及提高粘液和AMP的产生,证明了SCFA和缺氧/ HIF-1激活与肠上皮屏障的相关性;这些将微生物群落与上皮细胞隔离开来,这些作用共同避免了细菌过度生长和易位。
5
缺氧/ HIF-1和SCFAs调节肠上皮自噬(图3)
• 自噬是维持肠道稳态所必需的,因为它在调节上皮屏障功能和粘膜免疫反应中发挥作用
• 自噬为缺氧处理的Caco-2细胞的主要HIF-1靶向通路
• 相对于没有IBD的个体,缺氧可以激活自噬并减少IBD患者的肠道炎症
• SCFA对HIF-1的激活可以诱导IEC中的自噬,并且这一过程可能会抵消肠道炎症
• 微生物群- SCFA的联合作用似乎对于维持小鼠和人类肠上皮的生理性缺氧至关重要,协调其功能的几个方面,这些方面可以直接影响宿主的整体健康。
• 但是,有许多方面需要更详细地研究:其他微生物群衍生代谢物在该联合作用中的相关性;HIF-1对包括肠上皮细胞的不同细胞的作用;体内短期和长期激活HIF-1的差异。
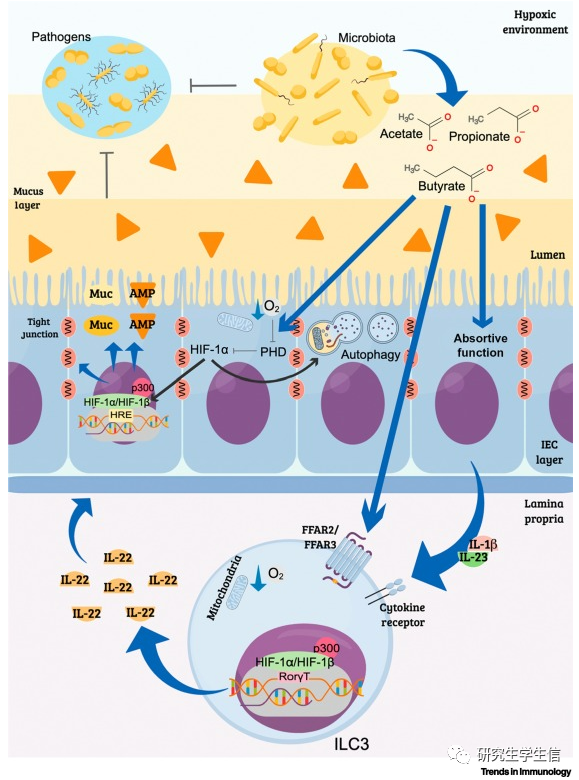
Fig 3微生物群衍生的代谢物可以促进缺氧和HIF-1的稳定。
主要作用包括:①促进氧气消耗②自噬③上皮屏障功能
6
缺氧、HIF-1和SCFA介导的ILC3调节
——这一小节主要还是对上一小节中免疫以及皮肤粘附相关肠道功能以及调节的补充
ILC3:3型先天淋巴细胞
是哺乳动物肠道中最主要的ILC之一,并且与IEC和肠道微生物群呈现出强烈的双向串扰,这些相互作用有助于维持肠道缺氧,因为它们会影响微生物群组成和代谢物的产生,并且可以通过肠道中O2浓度的变化来塑造。
• ILC3构成了对粘膜稳态和维持上皮屏障很重要的异质细胞群。这些细胞在小鼠肠道固有层中含量丰富,其特点是在组织损伤后产生细胞因子以响应驻留细胞(例如单核吞噬细胞)释放的信号
• ILC3产生的主要细胞因子之一是IL-22,在调节肠上皮功能和宿主-微生物群相互作用中起着至关重要的作用
• 具体而言,IL-22在小鼠和人类的胸腺、皮肤、肠道和呼吸道中诱导上皮细胞存活和增殖,并通过促进紧密连接蛋白和粘蛋白的表达以及促进粘液糖基化来促进肠道屏障功能,如鼠结肠炎模型和人类IEC。使用抗体中和IL-22和在IL-22敲除小鼠中进行的研究表明,这种细胞因子通过刺激肠道产生AMP,例如再生蛋白RegIIIγ来塑造肠道微生物群
• 相反,**微生物群衍生的信号,包括SCFA,可以调节ILC3反应。**
• 在稳定状态下以及在DSS诱导的结肠炎或肠道柠檬酸杆菌啮齿动物感染期间,小鼠口服丙酸盐或乙酸盐可增加结肠ILC3的数量和IL-22的产生。此外,ILC3表达受体FFAR2,其激活选择性地促进小鼠结肠ILC3数量和活性的增加。事实上,醋酸盐- FFAR2轴增强了肠道ILC3中IL-1R的表达,从而提高了ILC3对IL-1β和IL-22产生的敏感性;总之,这种诱导改善了小鼠对急性艰难梭菌感染的反应。同样,**SCFA还通过增强细胞因子信号传导和激活哺乳动物雷帕霉素靶蛋白(mTOR)通路来调节外周组织中的ILC3数量并减轻小鼠肠道感染。**
• 丁酸盐上调IL- 23体外刺激的小鼠ILCs产生的IL-22。该研究还表明,与未经治疗的小鼠相比,用200 mM丁酸盐在饮用水中口服治疗3周的小鼠可增加脾脏、肠系膜淋巴结和肠固有层中ILC3(和T辅助细胞群)产生的IL-22。
• 丁酸盐调控**相关机制:**丁酸盐通过ILC3和CD4 + T细胞上的FFAR3受体起作用,并诱导芳烃受体(AhR)和HIF-1α的表达,受mTOR和Stat3的差异调节。丁酸盐还增加了IL22中HIF-1α结合位点的可及性通过组蛋白修饰启动子,从而增强IL-22表达。丁酸盐对IL-22产生的影响也在人类细胞中得到证实:这种SCFA促进了HIF1A和AHR的表达,并在体外增加了人类CD4 + T细胞中的IL-22。
• 总之,这些发现表明:(i)SCFA是微生物群与肠道产生IL-22之间的关键环节;(ii)不同的机制和靶细胞(T细胞和ILC3)可以解释SCFA的IL-22促进作用;(iii)短链脂肪酸SCFA与控制肠道感染和炎症有关。
总的来说,这些小鼠ILC3研究表明,缺氧和mTOR-HIF1的激活调节了这些细胞的数量和免疫反应,特别是它们在肠道中产生IL-22的能力。因此,我们假设SCFA在调节该组织中的ILC3反应中也具有相关作用。我们认为,SCFA通过其对IEC对O2利用率的影响,或通过它们对产生ILC3激活介质的细胞的影响(例如,在艰难梭菌感染期间增加中性粒细胞IL-1β的产生)间接促进ILC3中HIF-1的激活。此外,它们可能直接调节ILC3中HIF-1和其他通路的激活,例如FFAR2和FFAR3受体的参与,从而影响ILC3的数量和功能。由于ILC3有助于维持上皮屏障功能和先天免疫,因此预计这些反应将有利于宿主-微生物群的串扰。然而,需要进行广泛而有力的研究来检验这些假设,并明确定义缺氧诱导的HIF-1影响肠道中ILC3的分化、维持和迁移的通路,以及它们对微生物群组成的影响。事实上,血液循环所提供的氧气供应的变化可能会如何调节这个系统,是未来研究的一个相关问题。
7
缺氧和HIF-1在炎症和/或感染性疾病中的相关性
不同炎症模型中HIF-1α激活的报告结果
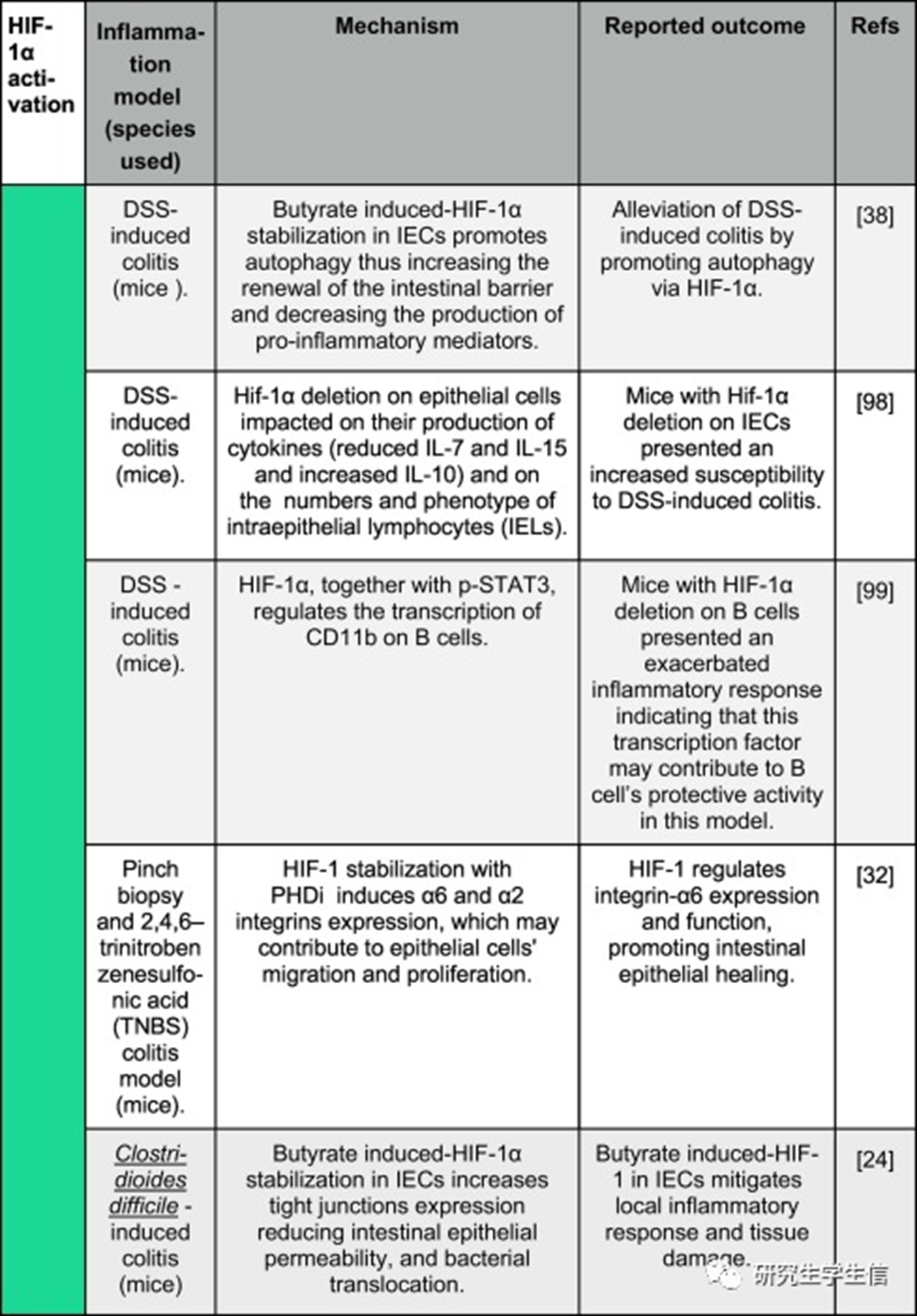
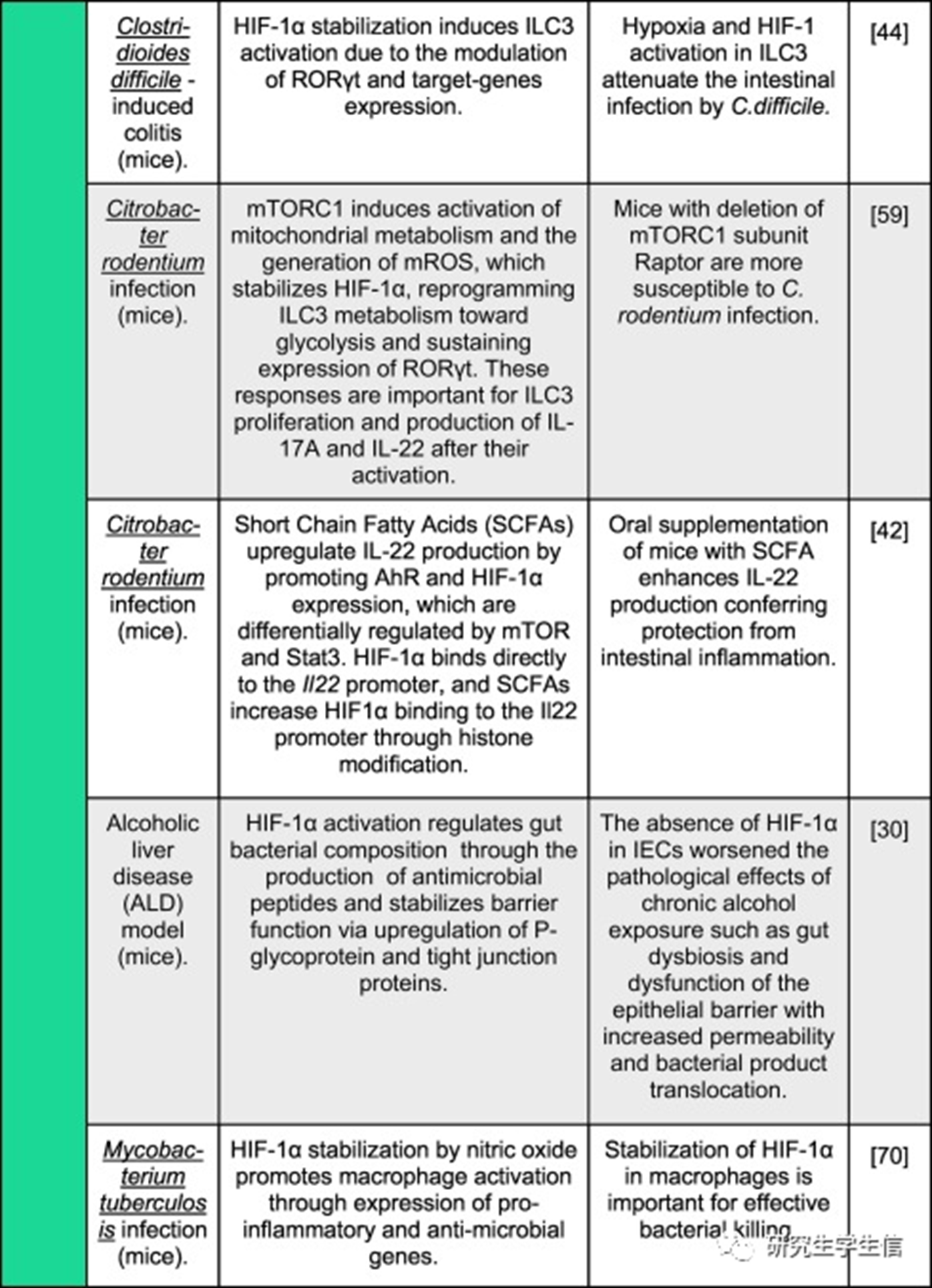
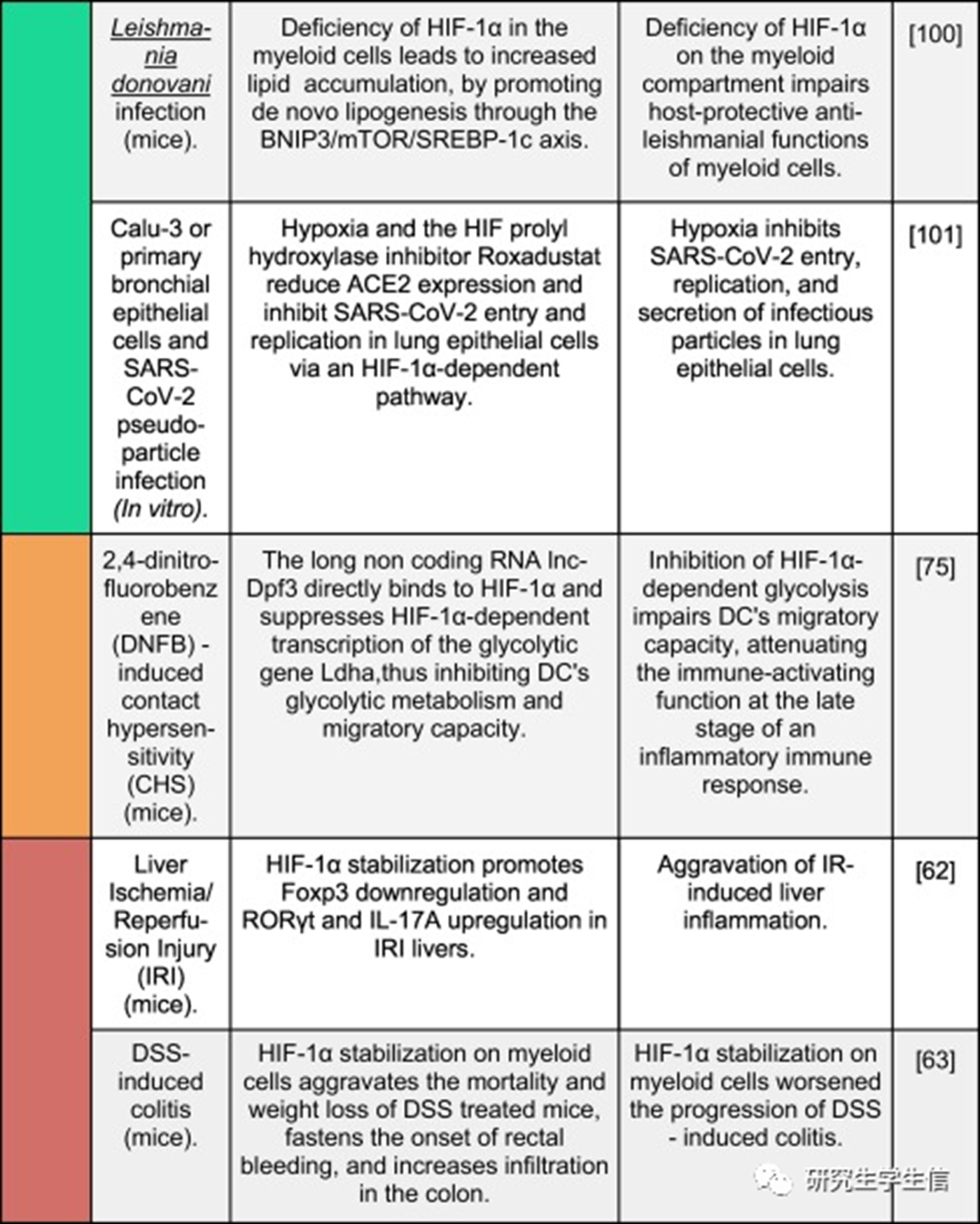
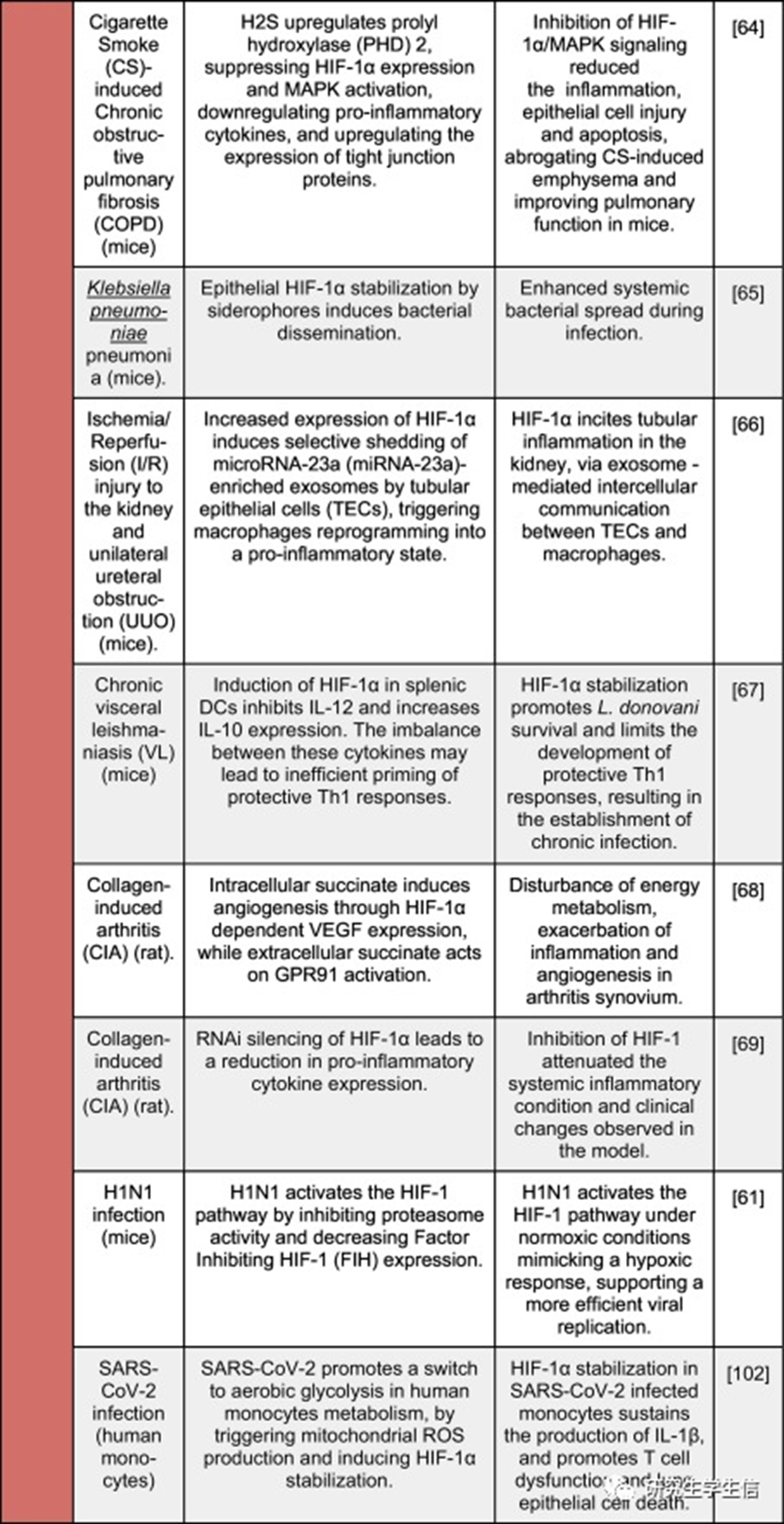
过去5年发表研究中HIF-1α激活对几种炎症/感染模型的影响的的示意图。彩色垂直条表示HIF-1α激活的整体效果,从绿色(对生物体的积极、有益的影响)到红色(对生物体的消极、有害的影响)。
一般来说,迄今为止,免疫或上皮细胞中该途径的激活对宿主对病原体的免疫反应和小鼠肠道炎症模型(如DSS-、艰难梭菌-和啮齿类杆菌-)的损伤产生了积极影响。**然而,这在其他炎症或感染模型中尚未观察到,例如,HIF-1激活恶化了小鼠肺部疾病的免疫反应和结果,例如由肺炎克雷伯菌感染引起的肺炎和慢性阻塞性肺纤维化,导致肺浸润和组织损伤增加。在小鼠缺血和再灌注损伤的背景下也报道了类似的发现。**
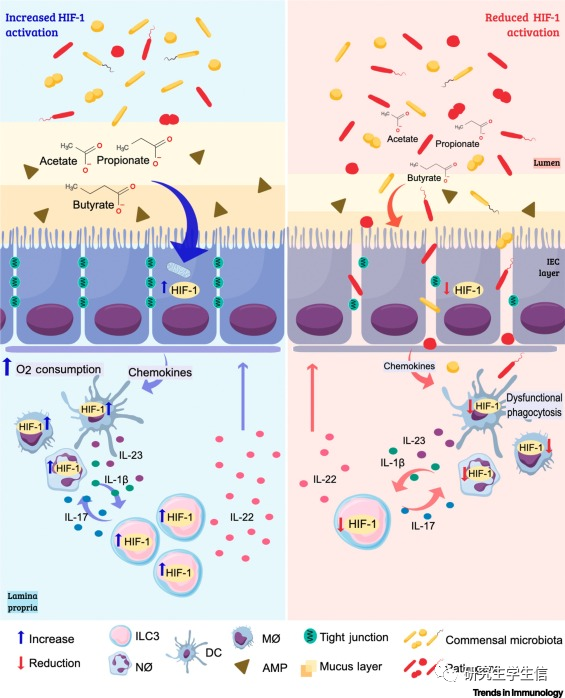
• HIF-1的激活通过在人和小鼠模型中产生粘液、抗菌肽和紧密连接蛋白的表达来促进屏障功能,减少了感染期间的细菌易位
• HIF-1的激活还促进了对驻留和募集的白细胞的积极影响
• HIF-1的稳定和HIF-1相关的中性粒细胞和巨噬细胞的代谢重编程有助于它们的杀菌作用和促炎细胞因子的产生
• ILC3对来自驻留细胞的白细胞介素(IL)-1β和IL-23有反应。SCFAs和HIF-1的稳定性提高了这些细胞的IL-17和IL-22的产生,从而增强了中性粒细胞的募集(这也有助于该部位的氧气消耗)并通过它们对肠上皮细胞的影响来增强屏障功能(IEC)。在没有HIF-1的情况下,IEC产生的粘液和抗菌肽(AMP)以及紧密连接蛋白的表达减少,从而损害了上皮屏障的通透性。
• 在气道感染反应期间HIF-1的激活可能导致有害的免疫反应和组织损伤
• HIF-1信号通路的降低影响ILC3中IL-22和IL-17的产生,从而导致免疫应答受损和肠上皮愈合
• 在感染期间,HIF-1α稳定可导致促炎基因的表达,增强巨噬细胞的活化,中性粒细胞的活化和存活,树突状细胞的成熟和迁移,以及可能有助于免疫防御的其他影响。总之,这些影响**可能通过提高免疫系统的效率与急性感染相关。然而,我们假设随着炎症过程的延长,HIF-1对免疫细胞的影响会导致组织损伤。研究报告了HIF-1α的稳定性作为小鼠和人类气道炎症反应期间的并发症预测因子,而其在肠道组织中的稳定性通常与改善结果有关在小鼠和人类中。这些结果可能是由于O2的高分压在呼吸道中,这可能导致该组织中自然低浓度的HIF-1α。此外,HIF-1α还与小鼠和体外H1N1和HIV的病毒复制和发病机制有关,通常会诱导细胞因子的产生。总之,这些发现表明,在气道感染反应期间HIF-1的激活可能导致有害的免疫反应和组织损伤**。
8
**有待探讨的问题**
• O2的生理浓度因哺乳动物体内的不同组织而异。从这个意义上说,HIF-1对于缺氧条件下的转录细胞适应至关重要,尽管细胞中还存在其他O2传感器,例如HIF-2和HIF-3。其他缺氧激活基因/传感器在稳态和炎症状态下的作用是什么?
• 随着O2浓度从黏膜下层到管腔下降十倍以上,沿着肠道组织存在梯度。因此,不同位置的IEC可能以不同方式受到缺氧的影响,需要不同的适应。缺氧/ HIF-1激活如何导致不同细胞的不同反应?涉及哪些细胞特异性基因/蛋白质?是否存在通过O**2**独立机制发生的HIF-1细胞特异性反应?
• 除了对小鼠上皮HIF-1稳定的影响,SCFA丁酸盐还抑制组蛋白脱乙酰酶活性,导致一般DNA高度乙酰化和染色质可及性增加。染色质乙酰化的增加如何影响HIF-1与DNA和其他核蛋白的相互作用?我们预计新技术(例如ATAC-seq和ChIP-seq)可能有助于解决其中一些问题。
• 肠道缺氧在人和小鼠的急性肠道炎症过程中发挥重要作用,作用于多种细胞,包括IEC和免疫细胞。然而,一些研究表明,慢性HIF-1稳定可能有害并加剧某些炎症状况。**HIF-1在不同细胞/组织和疾病中的急性和慢性激活的后果是什么?**
• 每日禁食/再喂食周期会改变小鼠和人类的肠道微生物群以及与SCFA产生相关的基因。喂养节奏和饮食类型的每日变化如何影响肠道细胞以及微生物成分中的缺氧和HIF-1表达/活性?
9
相关概念
[1]同工型(isoform):Any of two or more functionally similar proteins that have a similar but not an identical amino acid sequence.
[2]组成型表达:基因表达不受时期、部位、环境影响,没有时空特异性。
[3] β氧化:脂肪酸在一系列酶的作用下,在α碳原子和β碳原子之间断裂,生成乙酰辅酶A,和较原来少两个碳原子的脂肪酰辅酶A。脂肪酸β氧化过程可概括为活化、转移、β氧化及最后经三羧酸循环被彻底氧化生成CO2和H₂O并释放能量等。
图文:陈浩然
本文编辑:莫状