我校崔永萍/张玲教授团队在一区TOP期刊《Genome Medicine》发表最新研究成果
稿件来源:基础医学院 发布时间:2025-05-13 点击次数:
近日,我校细胞生理学教育部重点实验室、基础医学院食管癌发病机理及临床转化研究所联合四川大学华西医院在国际期刊《Genome Medicine》(中国科学院一区TOP期刊,IF=10.40)发表了题为“Multi-omics analysis reveals immunosuppression in oesophageal squamous cell carcinoma induced by creatine accumulation and HK3 deficiency”的论文。我校博士生高迎真为第一作者,张玲教授、崔永萍教授、成晓龙教授为共同通讯作者。

食管鳞状细胞癌(ESCC)是我国食管癌的主要类型,约占全国食管癌90%。其异质性高,5年生存率仅20%。近年来,免疫检查点抑制剂(ICI)等免疫疗法虽有一定疗效,但仅30%-40%的患者能够从中受益,且耐药现象普遍存在。深入探究ESCC的免疫微环境异质性和免疫抑制机制,对于发现新的治疗靶点、提升免疫治疗效果具有至关重要的意义。
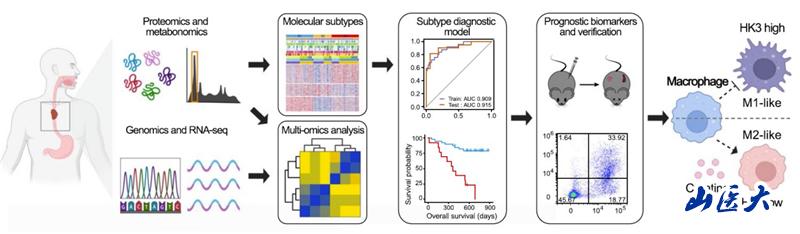
研究人员通过对ESCC的代谢组学和蛋白质组学分析,详细描绘了ESCC中的蛋白-代谢景观,并结合先前的基因组和转录组数据,丰富了ESCC的分子特征。进一步基于蛋白质组学和代谢组学鉴定出三个代谢-免疫特征显著差异的亚型(S1、S2和S3),并开发了亚型预测模型。S3亚型表现出最差的预后,其免疫微环境显著抑制,表现为M2型肿瘤相关巨噬细胞(TAMs)浸润增加,而CD8+T细胞、CD4+T细胞和NK细胞浸润减少。肌酸累积和己糖激酶3(HK3)蛋白表达降低是S3型的两个特征。研究人员随后通过动物实验和细胞实验发现,肌酸累积与HK3降低可能介导一种能量转化,二者通过重编程TAMs的能量代谢,协同驱动TAMs向M2型极化,重塑ESCC免疫抑制型微环境。
该研究通过多组学分析,从代谢-免疫交互视角解析了ESCC的微环境异质性,揭示了ESCC中肌酸积累和HK3缺乏对ESCC肿瘤微环境的重塑作用,强调了代谢重编程在肿瘤免疫抑制中的重要性。研究结果为靶向肌酸代谢以提高ESCC免疫治疗和靶向治疗效果提供了新思路。
崔永萍教授领衔的食管癌发病机理及临床转化研究团队长期致力于食管癌致病机理研究。团队取得的系列原创性成果,为阐明食管癌致病机制及分子分型、寻找有效的诊断标志物、药物靶点和制定临床精准治疗方案提供了理论依据。
(图文/高迎真)
复审复校:王卓
终审终校:侯小宝