第三临床医学院李学文课题组探讨Apelin-13对AngII诱导的HL-1心房肌细胞的保护作用
2020年9月,第三临床医学院李学文课题组在Physiological Research 杂志上发表了题为“Apelin-13 regulates angiotensin II- induced Cx43 downredulation and autophagy via the AMPK/mTOR signaling pathway in HL-1 cells”的研究论文,在体外建立Angiotensin II (AngII) 诱导的HL-1心房肌细胞重构模型,研究Apelin-13调控AngII诱导的HL-1细胞Connexin 43 (Cx43)重构和细胞肥厚的作用机制。
房颤(Atrial Fibrillation, AF)作为一种常见的心律失常,具有高发病率和死亡率(Sumeet et al.2014)。缝隙连接43(Connexin43, Cx43)是心肌缝隙连接中表达最多的主要缝隙连接蛋白(Xiao et al. 2016)。Cx43拓扑结构的改变或大部分由表达决定心脏组织电属性的通道数量的改变会促进心律失常包括AF的发生。已有研究发现Cx43重塑可以促进豚鼠心脏AF的发展,同样的结论在AF患者中也被发现(Shinohara et al. 2017)。因此,调控Cx43的保护性治疗可能是应对房颤的新策略。早在1998年,Tatemoto等发现牛胃中有一种蛋白激素Apelin-13,并在后续的研究中发现其具有直接或者间接影响心血管生理的多种生物学功能(Tatemoto et al. 1998)。同时,实验发现,AF患者的血Apelin水平比正常人低。低Apelin水平的AF患者数量比高Apelin水平的AF患者数量多三倍(Falcone et al. 2010)。并且Apelin-13可以抑制高糖条件下的心肌Cx43下调(Li et al.2018)。此外,AF患者循环血液中的脑钠肽(BNP)明显增加,用慢性BNP治疗快速心房起搏(RAP)兔和快速区域性刺激的HL-1细胞可以改善心房电重塑(zhao et al. 2019)。但是,Apelin在AF中的保护性机制目前研究较少。
因此,本课题建立AngII诱导的HL-1细胞模型,探究AngII诱导HL-1细胞模型Cx43下调的最适浓度(10uM)和Apelin-13干预的最适浓度(100nM)。实验结果发现,单独使用AngII处理HL-1细胞,Cx43表达明显下降,单独使用Apelin-13对Cx43表达无明显影响,但Apelin-13和AngII合用时,Apelin-13可以明显改善AngII诱导的Cx43表达(图1)。
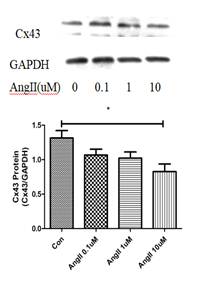

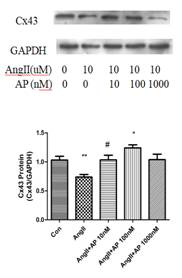
图1. Apelin-13和AngII对HL-1细胞Cx43表达的作用
李学文课题组进一步探究Apelin-13的作用机制,用CompoundC(AMPK抑制剂)或者Rapamycin(mTOR抑制剂)与Apelin-13共同处理模型细胞,探讨AMPK/mTOR通路在Apelin-13调控AngII诱导HL-1细胞Cx43下调和心肌肥厚的机制(图2)。结果显示,Apelin-13可以通过激活AMPK/mTOR通路逆转AngII诱导的HL-1细胞Cx43重构和细胞肥厚。
A.
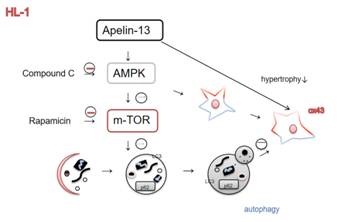
B. C.
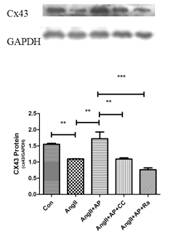
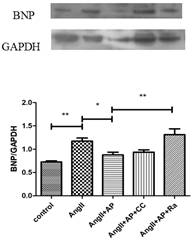
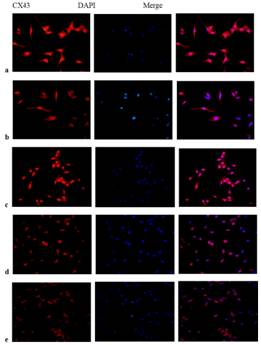
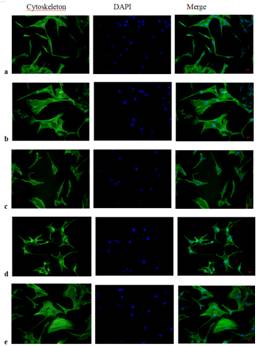
图2:Apelin-13调控AngII诱导的HL-1细胞Cx43重构和肥厚的机制
该实验首次发现Apelin-13可以通过激活AMPK/mTOR通路逆转AngII诱导的HL-1细胞Cx43下调和肥厚,进而对临床房颤的预防和治疗提供新的可能。未来将进一步探讨Apelin-13在在体和人体中的保护性机制。
山西医科大学第三临床医学院心内科李学文和山西医科大学病理学与病理生理学教研室的刘清华是共同通信作者,山西医科大学第三临床医学院心内科的陈奕帆是第一作者。该工作获得山西省研究生教育创新项目资助。