近日,本团队单细胞多维分析领域取得重要进展,相关研究以“Multiplex Profiling of Biomarker and Drug Uptake in Single Cells Using Microfluidic Flow Cytometry and Mass Spectrometry”为题发表在国际著名期刊《ACS Nano》上(中科院一区TOP,影响因子为17.1)。东北大学王建华教授、陈明丽教授和新加坡国立大学LimChweeTeck教授为共同通讯作者,第一作者为本团队青年教师张璇。
已有研究表明,肿瘤细胞表现出显著的单细胞异质性和标志物多样性,对其进行多维度单细胞分析有助于精准诊断和个性化治疗。然而临床样本中肿瘤细胞样品极为珍贵,通过传统离心的手段有可能造成样品损伤和丢失。
为解决上述问题,本工作开发了一种光谱-质谱二维单细胞检测策略,使用适配体标记的高表面积生物功能化纳米探针识别表达特异性蛋白的肿瘤细胞,利用集成了单细胞排列单元、样品纯化单元、荧光信号收集视窗的微流控芯片,对生物样品中的目标细胞进行聚焦、排列、纯化,借助激光诱导荧光(LIF)对6-FAM荧光基团的高响应信号和电感耦合等离子体质谱(ICPMS)对195Pt的高灵敏度识别,用于在单细胞分辨率下在线分析单细胞上的铂类药物摄取和受影响的PTK7蛋白质表达及其相关细胞表型分析。
与常规微流控螺旋通道相比,增强型螺旋单细胞聚焦单元可以在温和流速下实现单细胞的高通量排列;更为简洁的过滤纯化单元可以省去传统细胞样品处理中冗余的离心清洗步骤,极大地节约样品纯化时间并避免不必要的样品损失;依靠纳米粒子本身巨大的表面积(1.16×105nm2)耦联近3000条Sgc8适配体制成的高亲和力适配体纳米探针(Kd= 0.25 nM)可以识别样品中的所有目标细胞,这些标记荧光基团的适配体可以选择性地与靶细胞上的PTK7蛋白结合,并通过狭长的信号收集视窗以被LIF采集对应的单细胞荧光信号,进而提供细胞中PTK7蛋白的表达情况;随后引入ICPMS完成单细胞中奥沙利铂(OXA)药物的摄取情况定量分析。与传统单细胞商用雾化器相比,本策略的单细胞测量效率提高近9倍(90.6%),这对测定稀有细胞样品是极为重要的。此外,本方法采用水平进样方式,相较传统微流控芯片垂直进样方式可以尽可能地降低接口处不必要的绕流现象,有利于保持本已排列好的单细胞稳定地进入检测器,降低单个信号对应多细胞事件的风险。
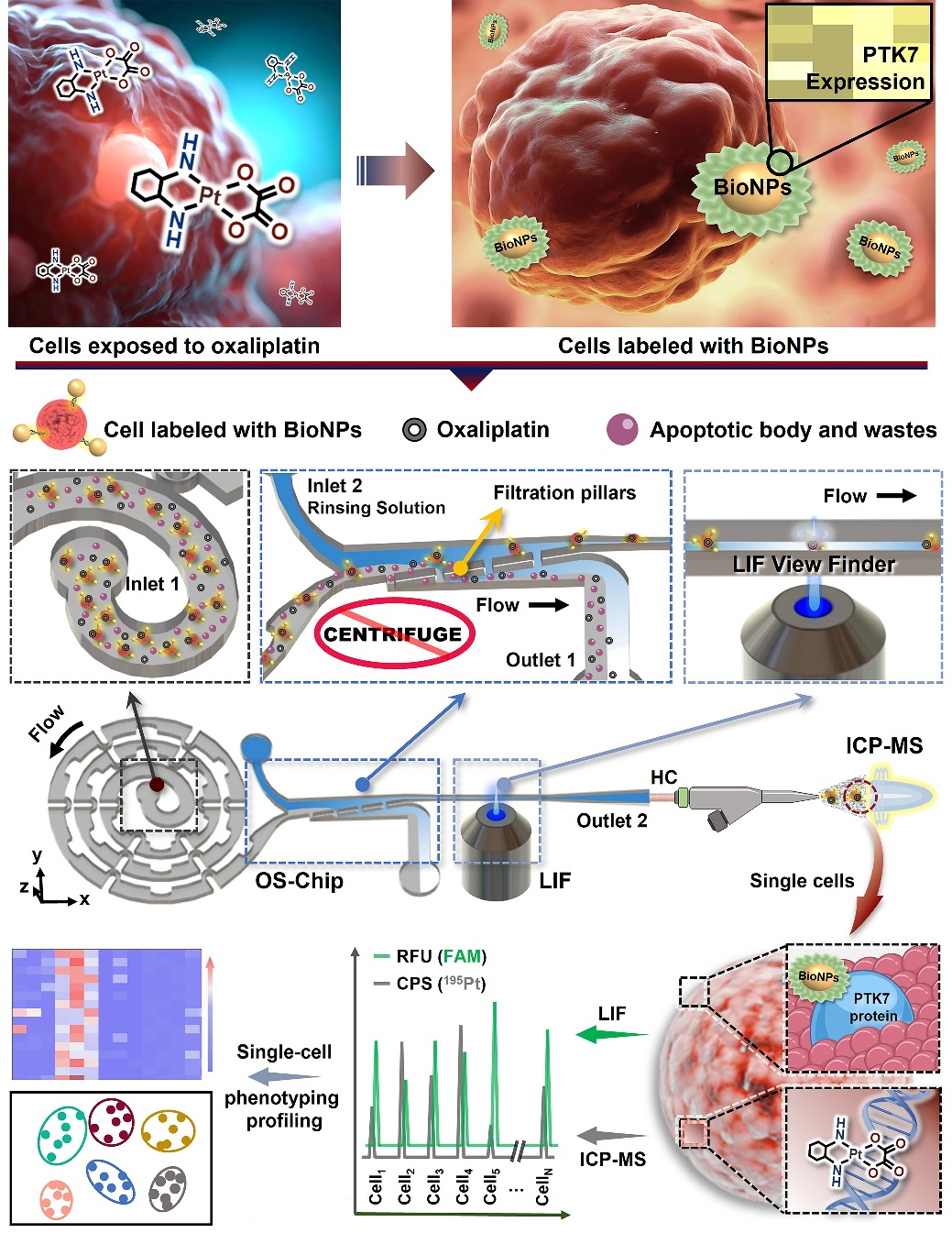
本系统进行单细胞光谱/质谱检测的工作原理



