2025年6月28日,我校细胞生理学教育部重点实验室曹济民教授团队在血管再生领域的国际权威期刊《Angiogenesis》(中科院一区TOP期刊,IF=9.2)在线发表了题为“Semaphorin 3A protects against thoracic aortic aneurysm dissection by suppressing aortic angiogenesis”的研究论文(DOI: 10.1007/s10456-025-09992-6)。该研究发现,信号素3A (Semaphorin 3A, Sema3A)通过抑制胸主动脉壁内血管新生、细胞外基质降解及炎症反应,而抑制胸主动脉瘤(TAA)进展和夹层(TAAD)形成。这一工作利用TAA/TAAD患者数据库及胸主动脉标本、Sema3A条件性过表达和敲除小鼠以及细胞模型,揭示了Sema3A是一种内源性的TAA保护因子,并发现外源性给予Sema3A重组蛋白可明显减轻小鼠TAA的进展和TAAD的发生。该研究为TAA的非手术防治提供了新的可能性以及潜在的药物靶点。基础医学院武栗妃讲师(曹济民教授2020级博士研究生)为论文第一作者,曹济民教授为主通讯作者。

TAA是指膈肌以上的主动脉形成的超过其正常直径1.5倍的扩张性瘤体,通常无明显症状,直至发生TAAD或破裂才表现为急症,是一种危及生命的严重疾病,死亡率可达90%以上。据统计,我国2021年大约有39,000例患者被诊断为主动脉夹层,给患者乃至国家带来了很大的医疗负担。现有的药物,如β受体阻滞剂、血管紧张素受体拮抗剂、TGF-β中和抗体只能使出现症状后的死亡率维持在50%左右。虽然手术是TAAD最为有效的治疗手段,但是手术风险高,而且也只能将死亡率降低30%。目前尚无有效药物能延缓TAA的发展并防止TAA破裂或夹层形成。已有报道,人TAA胸主动脉存在病理性血管新生且与夹层的发生密切相关,但其调控机制不清楚。本研究发现在TAAD患者和BAPN诱导的小鼠TAA/TAAD主动脉壁中Sema3A的表达水平显著降低,且Sema3A主要表达在主动脉平滑肌细胞中。小鼠全身性或血管平滑肌细胞特异性过表达Sema3A可显著减轻主动脉血管新生、炎症反应和细胞外基质降解,降低夹层发生率,提高小鼠的生存率;而小鼠血管平滑肌细胞特异性敲除Sema3A则可加重主动脉血管新生、炎症反应和细胞外基质降解,促进夹层的发生,降低小鼠生存率。进一步发现主动脉平滑肌细胞来源的Sema3A通过作用于内皮细胞的Sema3A受体NRP1而抑制ERK信号通路,进而抑制内皮细胞增殖、迁移和成管,从而抑制病理性血管新生。外源性给予小鼠Sema3A重组蛋白可减轻TAA相关的病理过程,明显降低TAAD的发生率。
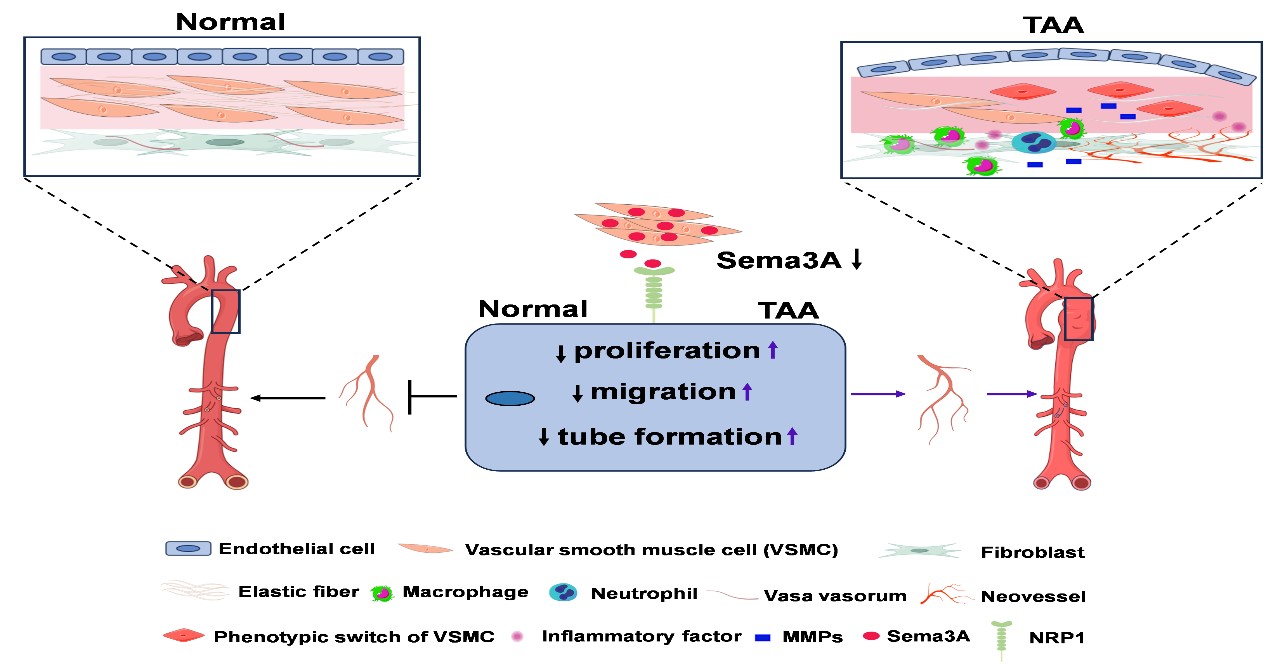
在正常主动脉壁中,由血管平滑肌细胞(VSMC)来源的Sema3A维持着生理水平。Sema3A具有抑制血管新生的作用。Sema3A作用于其在内皮细胞上的受体NRP1,抑制内皮细胞增殖、迁移和成管,从而防止胸主动脉病理性血管新生,维持主动脉稳态。TAA时主动脉Sema3A表达水平降低,从而促进主动脉壁血管新生、TAA的进展和TAAD发生。
本研究首次证明了Sema3A是TAA的一个内源性保护因子;促进主动脉平滑肌细胞内源性Sema3A表达或给予外源性Sema3A重组蛋白对TAA有治疗作用。作为一种可能的TAA非手术疗法,Sema3A重组蛋白有潜在临床价值。本研究揭示了大动脉稳态平衡的新机制,提出Sema3A是维持大动脉稳态的一个重要的内源性媒介;VSMC-内皮细胞之间的对话是Sema3A抗TAAD作用的关键机制。
图文:武栗妃
初审初校:曹济民
复审复校:陆 利
终审终校:王 卓



