2025年8月7日,山西医科大学曹济民/周鑫团队与清华大学基础医学院/北京生物结构前沿研究中心向烨课题组合作在《自然-通讯》(Nature Communications)杂志在线发表了题为“Structural insights into polymerase-catalyzed FAD capping of hepatitis C virus RNA”的研究论文。该研究利用X射线晶体学技术,揭示了丙型肝炎病毒(HCV)RNA 5′端合成FAD帽的分子机制,为HCV 防治提供了新的理论补充。

丙型肝炎病毒(Hepatitis C virus, HCV)可引起急、慢性丙型肝炎,以及肝细胞癌。到目前为止,全世界有超过1.5亿人感染HCV,并且每年有300万至400万HCV 感染新发病例。多数HCV感染者早期无明显症状,但病毒会在几乎沉默状态下持续损害肝脏,并导致肝硬化、肝癌等严重后果。每年全球HCV相关死亡人数约50 万, HCV也被称为“沉默杀手”。HCV是一种单股正链RNA病毒 (+RNA),属于黄病毒科丙型肝炎病毒属。最近的一项研究表明六种不同基因型HCV的负链RNA(-RNA)5′末端存在FAD帽结构,而特定基因型HCV的正链RNA(+RNA) 5′末端也存在FAD帽结构。FAD帽可帮助HCV RNA逃逸RIG-I介导的先天免疫识别,这很可能是HCV隐匿感染的主要原因。
HCV基因组RNA的复制依赖于其编码的非结构蛋白5B(NS5B)。NS5B与HCV +RNA的3′端结合,启动互补链HCV -RNA的合成。合成的HCV -RNA随后作为NS5B的模板,生成新的HCV +RNA,从而实现病毒基因组的复制。HCV NS5B 可无需外源引物从头合成其基因组RNA。在体内NS5B启动的从头合成过程中,RNA模板以及启动核苷酸和进入的核苷酸被容纳在活性位点,合成初始二核苷酸引物。随后核苷酸的掺入会诱导NS5B发生构象变化,使引发元件PE退出活性中心,并促使NS5B转变为持续延伸状态持续复制。在体外复制实验中,NS5B 可直接利用FAD而不能利用单个核苷酸启动HCV RNA的合成。
本研究解析了HCV RNA聚合酶NS5B以FAD作为起始核苷酸从头合成RNA(de novo initiation)、引物引发(primed-initiation)以及延伸状态下(elongation)的复合物结构。通过对这些复合物结构分析,以及一系列生化研究证据,表明引发元件PE的β loop中氨基酸残基M447和Y448直接与FAD的核糖醇基团相互作用,是NS5B起始阶段特异性识别FAD的关键元素。此外,FAD的腺嘌呤基团与HCV 基因组3′端的尿嘧啶形成碱基互补配对,是其被添加在不同基因型负链RNA(-RNA)5′末端的决定因素。进一步分析发现,在HCV RNA加FAD帽的延伸阶段,NS5B的C端linker中的W550与FAD的异咯嗪环相互作用,稳定了5′端的FAD帽结构。这种相互作用进一步诱导了产物链的构象变化,形成了一种尚未被观察到的、独特的RNA双链延伸中间态,利于RNA双链以不对称的运动模式进行延伸(图1)。本研究不仅为开发靶向HCV 的新型治疗药物提供了理论指导,同时由于FAD非典型帽有帮助逃避宿主免疫的功能,这一性质也可能被应用于开发新型mRNA 修饰方法,助力mRNA疫苗及治疗性药物的发展。
该项工作由山西医科大学教授/山西医科大学-清华大学医学院前沿医学协同创新中心研究员王德平主导,在清华大学团队协助下完成。我校细胞生理学教育部重点实验室曹济民教授、周鑫教授和清华大学基础医学院/北京生物结构前沿研究中心向烨教授为该论文的通讯作者,我校细胞生理学教育部重点实验室王德平教授和2019级直博生赵蓉为该论文的共同第一作者。上海同步辐射光源和清华大学中国蛋白质科学中心(北京分中心)提供了设备支持。该项目得到了山西医科大学-清华大学前沿医学协同创新中心、国家自然科学基金等的资助。
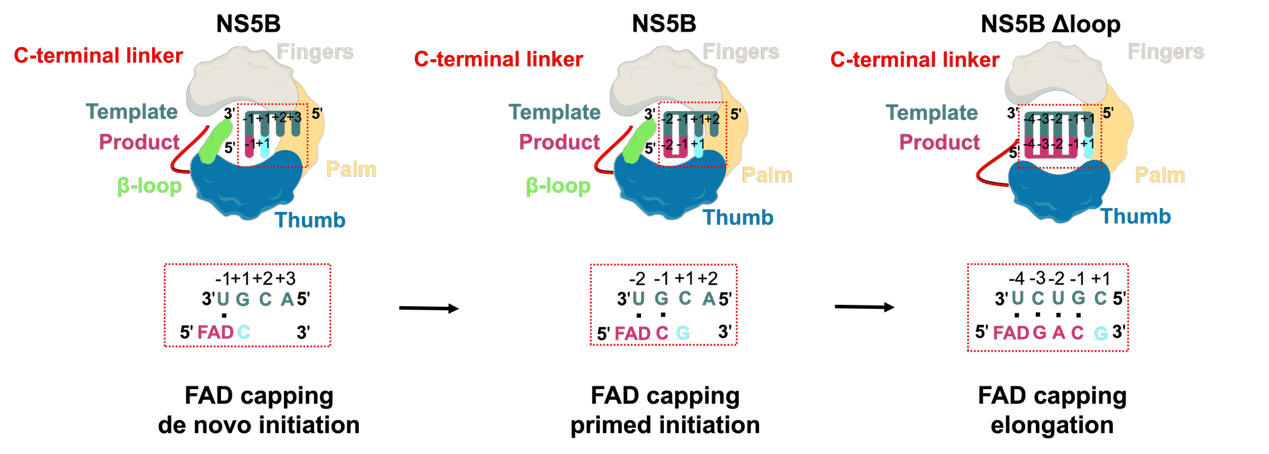
HCV的RNA聚合酶NS5B催化RNA 5′端加FAD帽的分子机制示意图
初审初校:封启龙
复审复校:张 宇
终审终校:王 卓



