骨髓间充质干细胞通过抑制破骨相关因子和分化为软骨细胞改善胶原诱导关节炎大鼠的骨侵蚀
类风湿性关节炎(RA)以对称性多关节炎为特征,滑膜炎症浸润以及免疫细胞和滑膜成纤维细胞之间的相互作用最终导致软骨和骨侵蚀。传统的类风湿性关节炎药物主要包括非甾体类抗炎药和传统改善病情抗风湿药物,这些药物通常会引起胃肠道副作用、肾损害、骨髓抑制和心理障碍。近年来对RA的研究进展已经阐明了炎症、自身免疫、细胞因子网络和各种细胞功能在RA发生和发病中的作用。多种靶向抑制免疫细胞、细胞因子及其信号通路药物的上市使许多难治性RA患者受益。然而,这类药物仅针对RA发病的某一步骤,而且价格昂贵。可引起注射部位、肿瘤及肺结核等传染病的反应,停药后易复发。此外,大约30%的患者对这种治疗没有反应,临床缓解的RA患者在影像学检查时显示进行性关节糜烂。因此,在RA的关节损伤后,关节糜烂不能通过药物治疗干预有效修复,是进行性关节损伤、继发性骨关节炎和关节功能障碍的危险因素。细胞、组织和基因工程的进步使得干细胞治疗适合于类风湿关节炎。间充质干细胞(MSCs)具有多能性,易于分离和扩增,特别是分化为软骨细胞,具有免疫调节和抗炎功能。因此,它们是修复RA患者关节损伤的理想治疗方法。大量研究报道MSCs在RA中具有免疫调节作用;然而,没有研究报道MSCs植入RA患者或RA动物模型的命运。外用MSCs后,MSCs迁移、归巢到关节组织以及抑制大鼠骨破坏的机制尚不清楚。
因此,为明确骨髓MSCs(BMSCs)对RA动物经典模型-CIA大鼠的干预作用,并分析其发挥作用的具体机制,山西医科大学第三临床医学院风湿免疫科张莉芸教授团队在大鼠体内实验中研究了BMSCs对CIA大鼠的干预效果,评估其关节炎指数、影像学及滑膜病理改变;通过尾静脉给药绿色荧光蛋白(GFP)标记的MSCs,追踪MSCs的迁移和归巢,并探讨其抑制骨破坏的机制,为BMSCs在RA的临床转化应用提供重要的理论和实验基础。该研究成果于2020年以“Bone marrow mesenchymal stem cells improve bone erosion in collagen-induced arthritis by inhibiting osteoclasia-related factors and differentiating into chondrocytes”为题发表于Stem Cell Research & Therapy上。
该研究结果显示:
1、大鼠BMSCs的分离、培养及鉴定
在标准培养条件下,大鼠骨髓间充质干细胞粘附在塑料基质上生长,呈现长纺锤状形态(图1A)。流式细胞术分析BMSCs表面抗原表型显示CD44、CD105和CD29表达,而CD45、CD34和CD31不表达。此外,在诱导培养基中培养后,BMSCs在体外具有成脂、成骨和成软骨分化的潜力(图1C-F)。此外,荧光显微镜下,市售GFP标记的MSCs的形态与我们实验室提取和培养的大鼠BMSCs相似,细胞显示绿色荧光信号(图1B)。
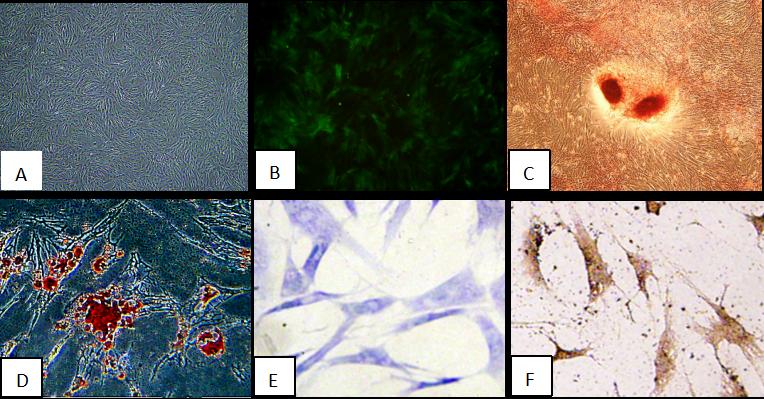
图1:BMSCs与GFP-BMSCs的特性
2.BMSCs移植对CIA大鼠的干预作用评估
经静脉输注BMSCs可改善CIA大鼠关节炎症,延缓CIA大鼠关节炎放射学进展,作用与RA经典药物MTX相似。
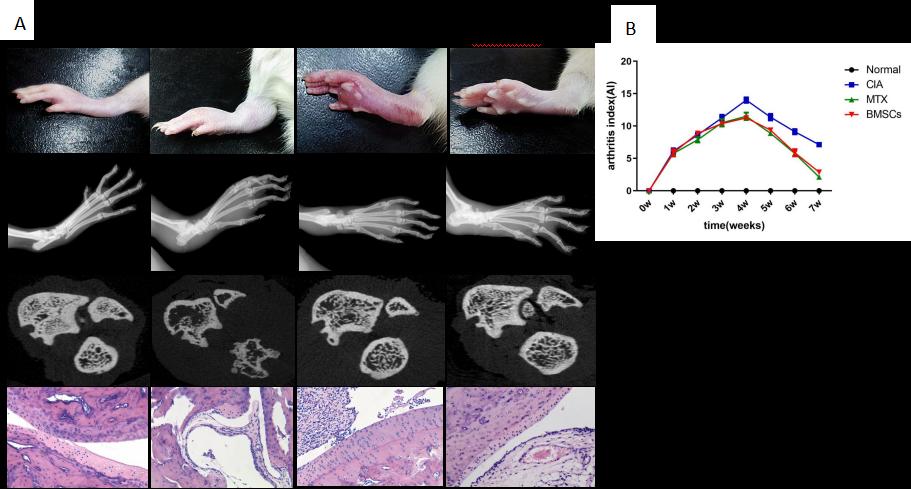
图2:BMSCs减轻了CIA大鼠的炎症反应,并抑制其骨破坏
3.BMSCs对CIA大鼠血清及滑膜中趋化因子轴及骨代谢相关因子表达的影响:
BMSCs抑制血清CXCL10的表达(图3A),并抑制滑膜处CXCL10和CXCR3的表达(图3B)。mRNA表达分析显示(图3C),BMSCs可能调节血清和滑膜组织中RANKL/OPG的表达水平。

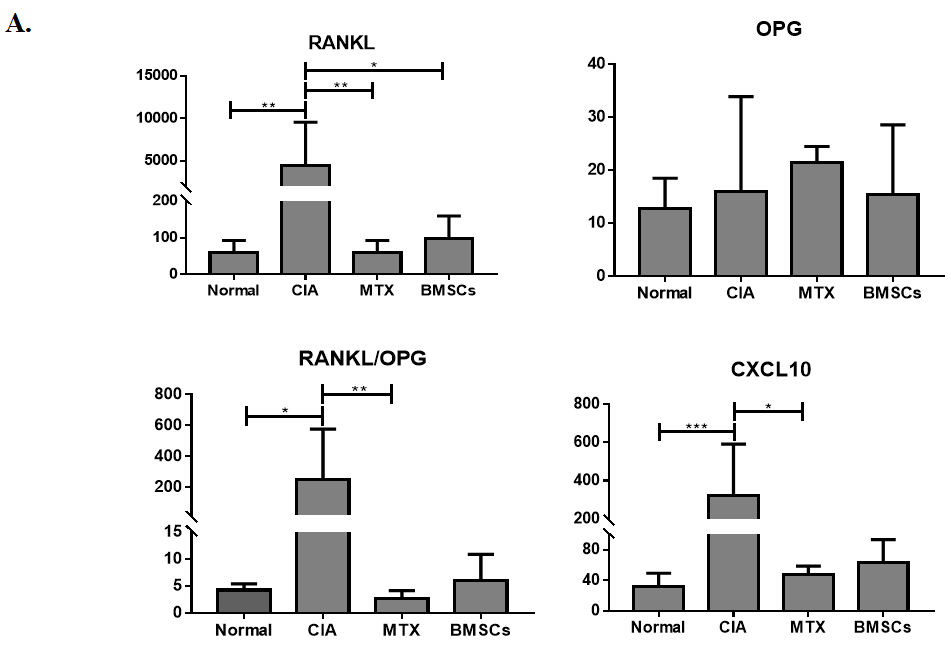
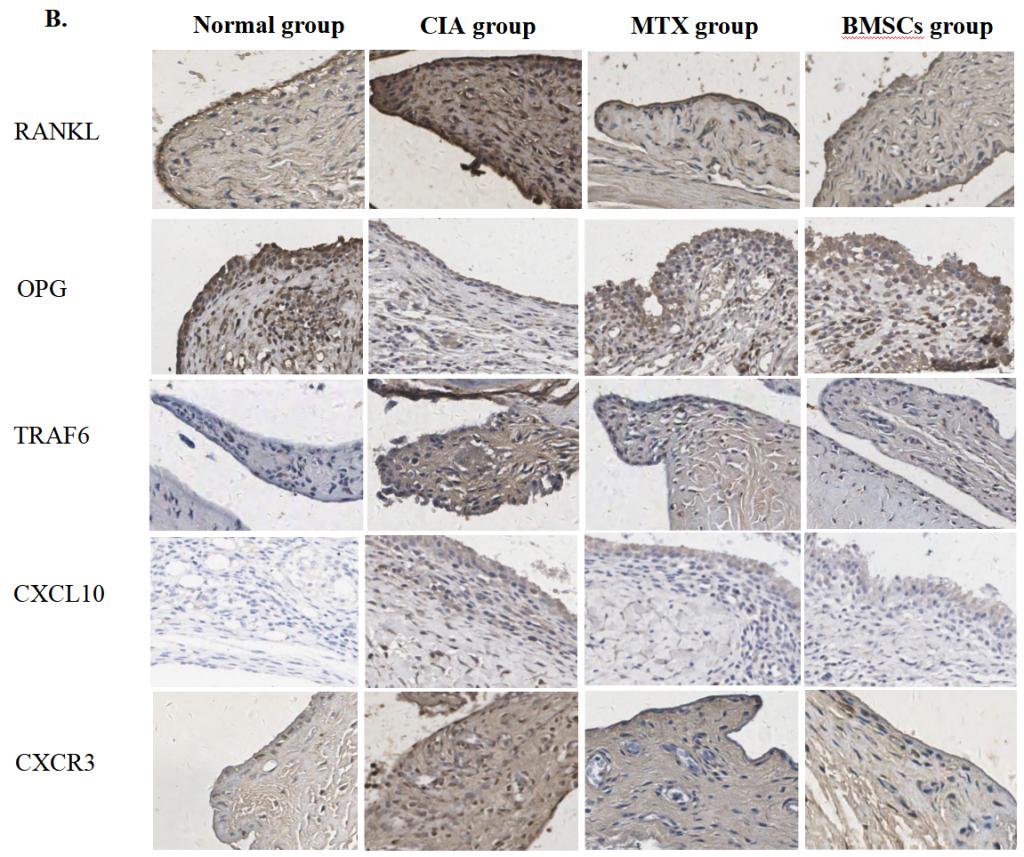
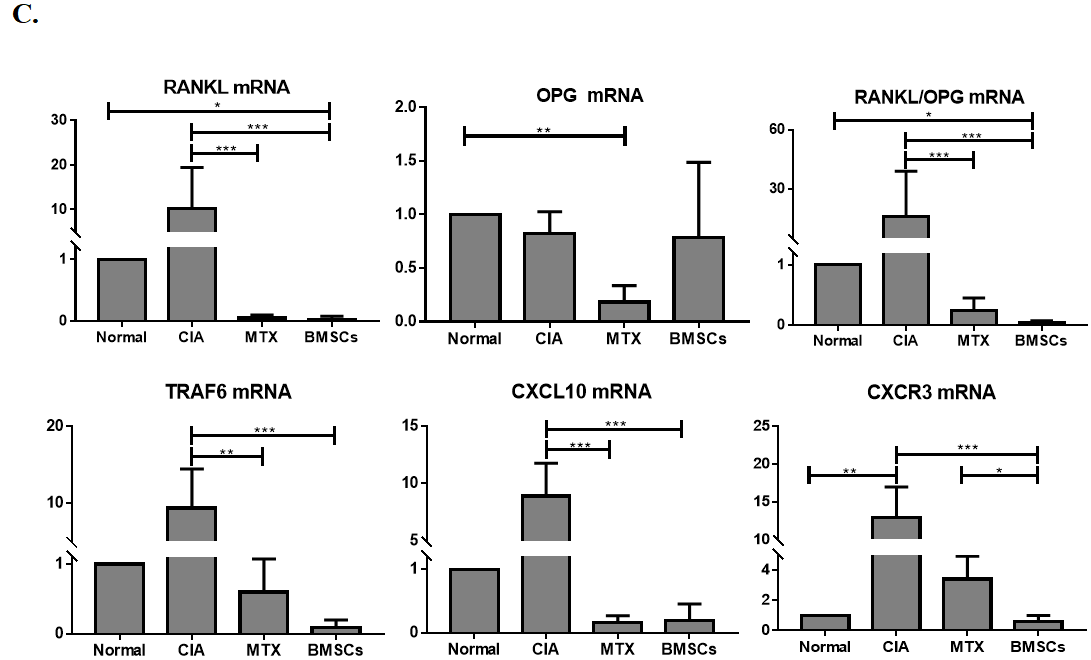
图3:BMSCs对CIA模型大鼠RANKL/OPG/TRAF6信号通路及CXCL10/CXCR3趋化因子轴的影响
4.CIA大鼠关节中GFP-MSCs迁移定植及软骨细胞分化的研究
干预后第3、11、30和42天,在CIA模型大鼠后踝关节中追踪GFP-BMSCs。移植3天后,GFP阳性细胞主要分布在骨髓和滑膜组织中(图4A、B、C),软骨组织中未观察到GFP阳性细胞(图4D)。从第11天开始在软骨中观察到GFP阳性细胞,并逐渐从梭形细胞转变为椭圆形/球形细胞(图4E),移植后42 d仍观察到GFP阳性细胞(图4F)。抗Ⅱ型胶原免疫荧光染色观察到关节软骨(尤其是受损软骨)中有抗Ⅱ型胶原/GFP双阳性细胞(图5)。
图4:GFP-BMSCs移植后3 d在滑膜软骨和骨髓中的分布
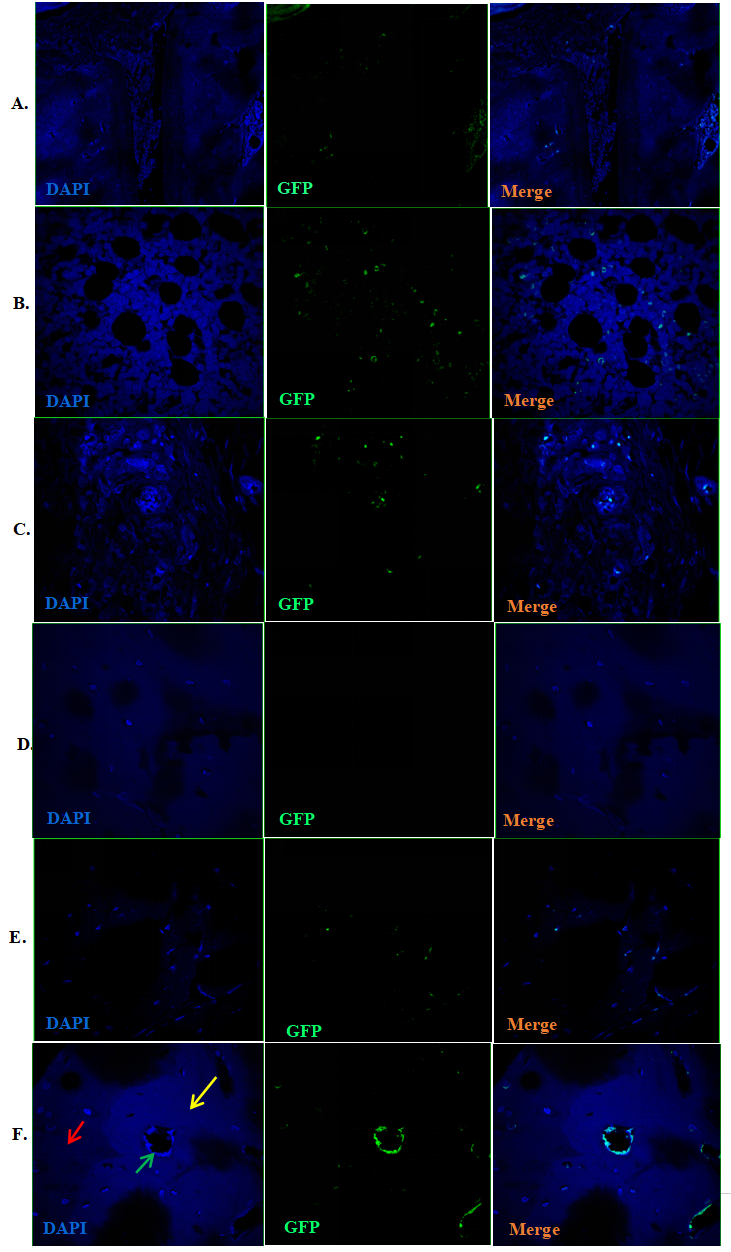
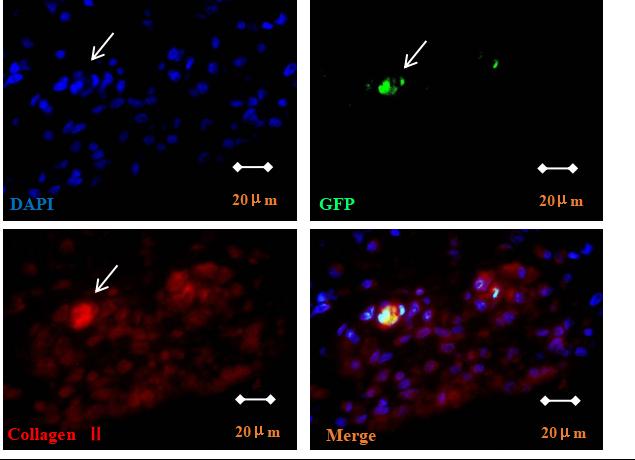


图5:免疫荧光染色显示BMSCs在软骨损伤部位转变为GFP/ II型胶原双阳性细胞(1000×)

综上,BMSCs可通过抑制CXCL10/CXCR3趋化轴和调节RANKL/OPG比值,并直接分化为软骨细胞,改善CIA大鼠的骨破坏,为BMSCs在RA治疗的临床转化应用提供重要依据。
张莉芸教授为本研究的通信作者,高晋芳为本研究论文的第一作者,该研究得到国家自然科学基金、山西省科技厅自然科学基金面上项目的支持。