三类外周T细胞淋巴瘤基因突变谱的特点及临床意义
T细胞淋巴瘤可以是惰性的或侵袭性的,占所有NHL的12%。由于NK细胞与T细胞密切相关,它们的恶性肿瘤也包括在该分类中。PTCL的起源是来自胸腺后的成熟T细胞或NK/T细胞,是一组非霍奇金淋巴瘤(NHL),具有高度异质性的形态学变化。根据2020年修订的WHO淋巴瘤分类,成熟T和NK细胞淋巴瘤和淋巴增生性疾病的分类超过27种亚型[1]。PTCL主要包括8个亚型,包括PTL.NOS、AITL、ALK+ ALCL、ALK-ALCL、肠病相关T细胞淋巴瘤(EATL)、单形上皮性肠T细胞淋巴瘤(MEITL,也称为EATL-II型)、具有TFH表型的外周T细胞淋巴瘤(PTCL-TFH)和滤泡T细胞淋巴瘤(FTCL)。
NHL也可分为惰性或侵袭性疾病。惰性淋巴瘤的特点是病程长,一般对标准化疗有抵抗力,而侵袭性疾病通常有急性表现,有B型症状,病情发展迅速。皮肤T细胞淋巴瘤(CTCL)被认为是惰性的,而包括其余的PTCL则被认为是侵袭性的。三分之二的CTCL是由放线菌病(MF)和塞扎里综合征(SS)组成。PTL.NOS是PTCL中最常见的,其次是ALCL和AITL。
根据NCCN肿瘤学临床实践指南,2020版T细胞淋巴瘤中。大约30-50%的T细胞淋巴瘤没有进一步分类,被称为PTL.NOS。在中国所有的NHL病例中,大约25-30%是PTCLs,明显高于欧美国家(10-15%)。目前,一线治疗仍然是CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松龙)或类似CHOP的方案(CHOEP)。然而,除了ALK+ ALCL外,大多数PTCL都是高度恶性的。恶性程度高,病程凶险,临床效果差,一线治疗后缓解率低,复发频繁。
表观遗传学是指基因表达的变化在不改变DNA序列的情况下发生的现象。发生而不改变DNA序列的现象,并且细胞调节的一些表观遗传学机制包括组蛋白修饰、DNA甲基化、非编码RNA的影响,以及染色质重组。异常的HDACs(组蛋白脱乙酰酶)的活动经常影响基因表达,导致肿瘤抑制基因的表观遗传学沉默和致癌基因的激活。在PTCL中已经观察到特别是RHOA基因(Ras同源家族成员A) G17V、异柠檬酸脱氢酶(IDH2)和Ten-Eleven易位-2(TET2)突变更有可能导致亚型表现为T-滤泡型辅助表型,如AITL和PTL.NOS等。组蛋白修饰基因的突变与PTCL的疾病进展有关。使T淋巴瘤细胞对表观遗传药物敏感。在AITL和PTL.NOS之间存在一些突变基因的相似性,如TET2和肿瘤抑制因子DNA甲基转移酶3A (DNMT3A)在原始干细胞中存在异常。
在最近修订的2017年WHO分类中,被定义为nPTCL-TTFH并被纳入的一种亚型,即 "AITL和其他TFH细胞来源的T细胞淋巴瘤"。该类别中的肿瘤细胞,包括AITL、nPTCL-TFH、NPTCL-TFH和AITL-TFH,都是TFH细胞来源的肿瘤。这一类的肿瘤细胞包括AITL、nPTCL-TFH和滤泡T细胞淋巴瘤(FTCL),必须至少表达以下两项(最好是三项): 基于IHC的TFH标志物:CD10、BCL6转录抑制器(BCL6)、程序性细胞死亡1(PDCD1/CD279/PD-1),C-X-C动点趋化因子配体13(CXCL13),趋化因子受体5(CXCR5),诱导性T细胞成本刺激(ICOS)以及信号淋巴细胞活化分子相关的蛋白(SAP)。
根据GEPs将PTL.NOS进一步分类如下:PTL. NOS具有1型辅助T细胞(Th1)特征,表达T-bet(TBX21)和其靶点为PTCL-TBX21(49%的PTL.NOS);PTL.NOS具有Th2特征并表达GATA结合蛋白3(GATA3)及其靶点的PTCL-GATA3(33%);以及PTL.NOS两者均无特征,为 "无法分类"(18%)。PTCL-GATA3亚组的患者预后比PTCL-TBX21亚组中的患者差。Wang等研究GATA3的表达区分了具有不同分子特征的PTL.NOS亚组。Lone W [39]等报道,GATA3的表达区分了一个PTL.NOS亚组,具有明显的分子特征,Th2特征和不良预后。PTCL-GATA3亚组的激进的临床过程可能是由于致癌途径的高活性和相对于PTCL-TBX21而言,该组患者的基因组异常情况更为复杂。与PTCL-TBX21相比,该组的基因组异常更为复杂。
ALCL是一组CD30+成熟T细胞淋巴瘤,具有相同的形态学和免疫表型特征,但在临床和遗传特征上表现出异质性。目前,各种类型的间变性大细胞淋巴瘤约占全世界PTCL的15%[40]。根据世界卫生组织的造血和淋巴组织肿瘤分类,ALCL有四种亚型:ALK+ALCL)、ALK−ALCL)、原发性皮肤ALCL (pcALCL)和乳房植入物相关ALCL (BIA-ALCL)。分子遗传学表现也为多种,如:大多数病例(约80%)显示染色体易位t(2;5),导致2p23位点的ALK基因与5q35位点的核磷胺(NPM)基因融合。嵌合ALK融合蛋白的存在提示在这些淋巴瘤的进展中起着至关重要的作用[41]。总而言之,13%的病例涉及原肌凝蛋白3 (TPM3: 1q25), 1%的病例涉及IMP环水解酶/5氨基咪唑-4-羧酰胺核糖核苷酸甲酰转移酶(ATIC: 2q35), 1%的病例涉及trk融合基因(TFG: 3q12.2)。其他易位的发生率均低于1%,包括肌凝蛋白重链9 (MYH9: 22q11.2)、格网蛋白重链(CLTC: 17q23)、原肌凝蛋白4 (TPM4: 19p13.1)、moesin (MSN: Xq11-12)、无名指蛋白213 (RNF213: 17q25)。所有突变易位导致ALK -酪氨酸激酶激活,这是发生间变大细胞淋巴瘤的一个重要环节。
组成性活性的ALK融合蛋白通过磷酸化以及较多信号通路的激活诱导肿瘤发生。信号转换器和转录激活因子3 (STAT3)的致癌活性是通过其对参与细胞周期、死亡、免疫系统、脉管系统和代谢的多种靶基因的控制介导的。STAT3通过模拟生理促生长信号,如IL2和TCR信号通路,促进肿瘤细胞增殖和存活,在ALCL的形成中发挥关键作用。最近的研究表明,干扰素调节因子4 (IRF4)是STAT3的关键靶基因,通过激活转录因子MYC促进肿瘤细胞存活。然而,独立于IRF4基因突变(易位或过表达),IRF4被证明可以诱导ALCL肿瘤细胞存活。这一过程被描述为骨髓瘤细胞中的一个自动调节电路,IRF4直接靶向MYC,同时也作为MYC转激活[45]的直接靶点。目前ALCL的治疗CHOP是应用最广泛的治疗方案。多项研究发现,五年后的总生存率和无进展生存率(PFS)分别超过70%和60%。在一项主要的分析中,德国高级别非霍奇金淋巴瘤研究组(Deutsche Studiengruppe hoch恶性非霍奇金淋巴瘤研究组)研究在CHOP中添加依托泊苷,通常以CHOEP的形式(依托泊苷,第1、2和3天100 mg/sqm)。
AITL、PTL.NOS和ALCL在PTCL中是较为常见的三种,这三类均具有复杂的遗传学改变,极具有异质性,预后也不同,相比较而言,PTL.NOS预后最差,异质性最强,表现在形态学方面也如此。AITL在形态学及免疫组织化学方面都有一定的特点,对应的分子基因的突变也有一定的特点;ALCL形态学更有特点,典型的异常细胞及CD30的弥漫强表达就可以让我们做出诊断,遗传学上也有一些明确的分子遗传学的改变;PTL.NOS形态学存在很多异质性,没有明确形态特点及免疫组织化学的表达,分子遗传学目前也仅仅认识到一部分,可能和不同的基因通路相关的分子改变,但研究此类淋巴瘤还是难上加难,应该应用二代测序、蛋白芯片等高通量技术,来探究其分子遗传学里更多的基因改变,从而可以更好地了解肿瘤发展的分子基础,并为肿瘤的干预及治疗寻找新的基因靶点。
利用1021个基因靶向测序,检测了41例PTLC和4例反应性淋巴的基因突变位点,其中1例ALCL未检测出突变基因,其余病例中发现210个基因突变点,PTL.NOS16例中检测到90个突变基因,AITL17例中检测到95个突变基因,ALCL7例中检测到25个突变基因,基因突变频率较高的6个基因依次为:TET2、RHOA、DNMT3A、 致癌转录因子(TCF3)、小突触前体细胞基质蛋白(PCLO)、(F-Box和WD重复结构域包含7)FBXW7。这些基因分别在三类淋巴瘤中均有不同得突变率,如:TET2、DNMT3A、TCF3、FBXW7、PCLO。可能提示三类T细胞淋巴瘤之间存在一定的交叉改变,在AITL中TET2表达率94%,RHOA82%,DNMT3A47%,IDH2 41%,TCF341%,PCLO24%,FBXW724%。在PTL.NOS中TET2表达率为38%,PCLO38%,FBXW7 38%、TP53 31%、TCF3C25%、DNMT3A25%、共济失调毛细血管扩张突变基因(ATM)19%。在ALCL中TCF3 43%、ERBB2受体酪氨酸激酶4 (ERBB4) 29%、PCLO29%、DNMT3A29%、TET2 29%、FBXW7 29%。(图1)
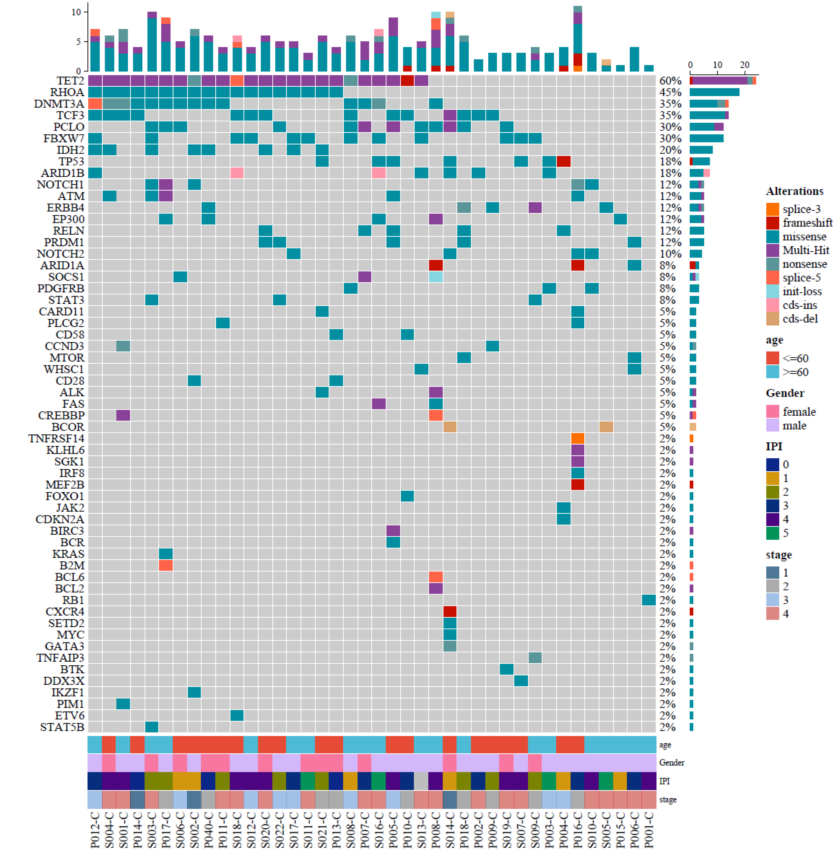
图1 全部病例基因突变全景图
我们的课题组发现PTCL中GATA3阳性组的VAF(一种新肿瘤标记物)中位值高于阴性组,提示GATA3阳性组与肿瘤负荷相关,而与检测出了突变基因未发现有相关性,可能说明GATA3/TBX21分组与PTCL不同于突变基因谱在疾病中发挥的作用。(图2)
图2 PTCL中GATA3/TBX21与VAF中位值的关系
另外总结三类外周T细胞淋巴瘤中所有基因的突变比例和突变基因的种类,发现在AITL和PTL.NOS 间存在共同的基因突变类型如:TET2、DNMT3A、TCF3、PCLO及FBXW7。在AITL中RHOA和IDH2表达较特殊,仅在AITL中检测到这两种基因的突变,而且突变率较高,提示此种基因可能作为鉴别AITL和PTL.NOS的特点基因,在病理诊断中可以做为一种鉴别的手段,而且有关报道也提出了存在RHOA和IDH2突变时,对应的AITL形态学上也极具特点,镜下表现为大片异型透亮细胞,围绕在增生的高内皮静脉周围,还会混杂一些免疫母细胞及浆细胞、组织细胞及嗜酸性粒细胞。这些改变都可能提示在基因改变的背景下PTCL会呈现出不同形态学的特点。ALCL发生TCF3基因突变较高,同时存在PCLO的突变,虽然比例不高,但可以提示与PTL.NOS的基因中也是存在交叉的。ALCL也是一类极具形态学特点的淋巴瘤,推测是否是TCF3突变基因的引导下形态学才会出现奇异核、马蹄核及肾形核等特点,周围炎细胞浸润。同样在PTL.NOS出现TCF3突变时总结其形态学特点,可能也会出现怪异核形及炎细胞浸润,在PTL.NOS没有形态学特点的情况下,借助基因的改变可能也是一种有效诊断手段。
我们实验结果显示基因突变数据与此类文献也非常接近,尤其在PTL.NOS和AITL中存在TET2可能提示在原始造血干细胞发生表观遗传相关的一些基因突变,如TET2、DNMT3A,DNMT3A是髓系淋巴瘤和T细胞淋巴瘤中最常发生突变的基因。DNMT3A突变包含几个点突变,R882H、R882C突变是最常见的突变。最近的研究发现DNMT3A R882突变与复发、不完全缓解率和低平均生存时间相关,常在急性淋巴细胞白血病中存在突变。有报道表明,DNMT3A或其突变体的缺失会导致造血干细胞的异常增殖,转化为对化疗药物有抗药性的白血病前干细胞,并导致AML患者复发[52]。TET2和DNMT3A同时参与调控DNA甲基化,异常时导致DNA甲基化失调,发育成异常的T或B细胞,再经过第二次基因突变后引起CD4阳性的T细胞发生单克隆增殖,从而成为T细胞淋巴瘤。同时如果B细胞在接受微环境的影响及EBV病毒的感染也会发展成B细胞淋巴瘤。Bustelo XR等人认为DNMT3A在CD8 +外周T细胞淋巴瘤中是一种单倍不足的肿瘤抑制因子。DNMT3A的表达降低与抑癌因子p53的下调有关,这也可能有助于CD8 + PTCL的发病机制。
TCF3功能异常时,可刺激B细胞受体信号,特别是通过激活PI3K激酶途径来完成。多数异常表现在B细胞淋巴瘤中,AITL中B细胞分布较PTL.NOS多,而且存在异常,可能检出较高的TCF3突变也和异常的B细胞较多有关[54]。我们的研究结果中TCF3突变主要集中在ALCL和AITL中,可能提示在这两种T细胞淋巴瘤中存在PI3K激酶通路的异常及B细胞的异常作用。如在裸T细胞型ALCL中与B细胞淋巴瘤难以区分,可能就是在基因的异常方面出现了一些相似的改变,引起形态学上的混淆。
PCLO是脊椎动物特有的基因,它编码突触前活动区(介导神经递质释放的专门区域)的大量蛋白质成分。10-12 Piccolo已被发现与突触前f -肌动蛋白相互作用并控制其组装,这对调节突触囊泡周期很重要,这表明它可能通过这种相互作用调节神经递质释放有趣的是,人类PCLO的突变不仅导致突触功能障碍,还导致大脑和小脑容量的损失,这表明严重的神经元损失。突触活性对于防止细胞凋亡至关重要,因此可以想象PCLO缺失导致的突触退化会触发神经元中的凋亡信号。有研究表明PCLO可能在钙感测中起作用。在包括DLBCL、PTCL等在内的多种肿瘤中,通过全外显子测序检测到PCLO突变。在胶质母细胞瘤间质亚型中,PCLO突变已被证明与预后不良相关, 我们研究的结果显示PCLO基因突变组预后相对较差,虽然目前其与PTCL预后的相关性尚未报道,但出现预后差的提示,可能也需要进一步的探究工作,来解决其作用机制和对PTCL的作用。
在PTL.NOS中检测到共济失调毛细血管扩张突变(ATM)基因的异常,而且ATM突变组的预后也是较差的,关于这个基因我们还需要进一步研究。共济失调毛细血管扩张症是常染色体的以进展为主要特征的隐性疾病小脑性共济失调,眼部毛细血管扩张免疫缺陷[65]。这种疾病是由基因突变引起的共济失调毛细血管扩张突变(Atm)基因。ATM基因产物Atm是一种含有3050个氨基酸的蛋白激酶,属于磷酸肌醇3激酶相关蛋白激酶超级家族。ATM主要位于细胞核中,尽管在与过氧化物酶体相关的细胞质中也发现了ATM。ATM作为一种多功能蛋白激酶,通过调节多种底物的磷酸化,在细胞周期控制、DNA损伤与修复、细胞生存与死亡等方面发挥着至关重要的作用。当这个基因发生异常时,细胞周期和DNA修复等功能失调,引起的肿瘤的发生发展。对于这个新认识的基因我们还有待于进一步研究,发现其在T细胞淋巴瘤中的作用及意义。
综合对比分析三类PTCL之间的基因突变的关系,发现TET2、IDH2及RHOA在AITL中显著高突变。充分说明这三个突变基因在AITL还是有一定的特征性改变,能够鉴别AITL与其他T细胞淋巴瘤的同时,也在形态学上给予了一定的提示作用。这也提示在PTCL中的各种形态学的背景下隐藏着不同类型基因的改变特点,我们应该进一步扩大病例数据的基础上,总结归纳出各类淋巴瘤不同基因下形态学的特点。(图3)
图3 PTL.NOS、AITL和ALCL基因突变相关分析图
研究发现的相关突变基因TET2、IDH2、RHOA、DNMT3A、TCF3、PCLO、ATM及FBXW7等,与最近的测序研究确定了TET2、RHOA、DNMT3A和IDH2的反复突变和相互作用较类似,提出了以TET2为代表的表观遗传调控在解释AITL多步骤、多谱系的肿瘤发生过程中发挥着越来越重要的作用,为AITL患者提供了新的研究方向和治疗策略,推测TET2可能可以作为AITL今后治疗的靶点。我们的研究分析发现TET2和RHOA突变组的PTCL预后较差,也能间接的指出其基因发生突变更易引起的肿瘤事件,所以提示我们应该诊断这类基因及相关分子机制通路寻找靶点,指导治疗。
目前研究发现TCF3、PCLO、ATM及FBXW7在肿瘤发生的机制中的具有重大作用,致癌转录因子(TCF3)功能异常时,可刺激B细胞受体信号,进而发生B细胞淋巴瘤。FBXW7影响细胞存活、细胞增殖、肿瘤侵袭、DNA损伤修复、基因组不稳定性和端粒生物学等许多调控功能。ATM作为一种多功能蛋白激酶,通过调节多种底物的磷酸化,在细胞周期控制、DNA损伤与修复、细胞生存与死亡等方面发挥着至关重要的作用。有研究表明PCLO在钙感测中起作用,在包括DLBCL、外周T细胞淋巴瘤等在内的多种肿瘤中,通过全外显子测序检测到PCLO突变,在胶质母细胞瘤间质亚型中,PCLO突变已被证明与预后不良相关。它们的突变在淋巴瘤的预后意义中可能也有一定的提示作用,我们研究预后分析结果显示PCLO突变组和ATM突变组预后较差的,也许能说明它们可能是独立的预后因素,进而在分子机制通路方面可能也有所提示,为今后T细胞淋巴瘤诊疗与评估预后寻找靶点。(图4-5)
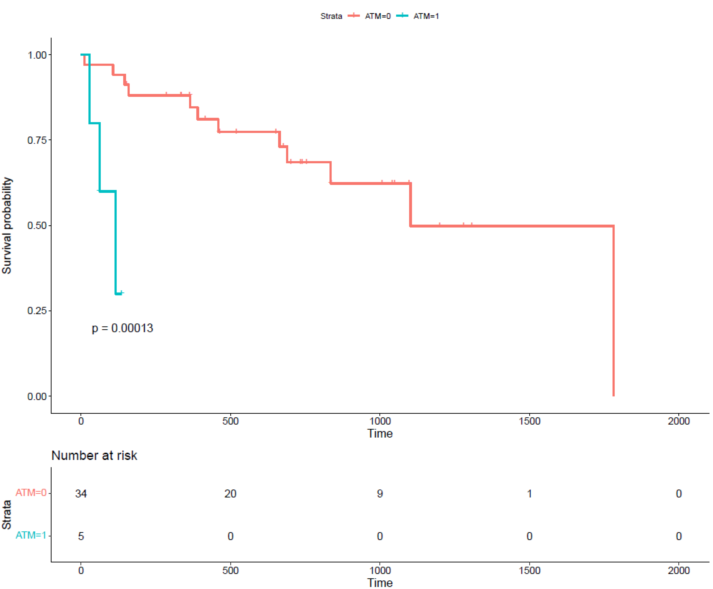
图4 ATM与PTCL预后的相关性分析图
图5 PCLO与PTCL预后的相关性分析图
VAF是基因组中特定位置突变分子数量占野生型分子总数的比例,与临床特征和预后密切相关,被认为是一种新的肿瘤负荷生物标志物。Fu等人发现TP53 . y88c和LATS2 . f972l的VAF在B细胞淋巴瘤合并CR患者中降低。非DNMT3A克隆的中位VAF从自体干细胞移植(ASCT)时的1%增加到诊断治疗相关髓系肿瘤(tMNs)时的37%。我们研究发现,骨髓
受累的患者,VAF最大值和中位值均升高。此外,我们观察到最大值VAF患者与中位值VAF患者,OS和PFS较差。(图6-7)
图6 PTCL在VAF中位数值下的生存分析图
图7 PTCL在VAF最大值下的生存分析图
综上总结,本研究通过对高通量测序发现三类PTCL的基因突变谱,在三类T细胞淋巴瘤之间存在共同的基因,同时也各自发现了每类中相对独有的一些基因,提示有些独特的基因可以直接做为鉴别诊断哪类T细胞淋巴瘤的一个依据,而且不同基因的突变可能出现形态学上特异性。今后我们将扩大标本量,在蛋白水平等方面验证这些基因在PTCL中的作用,从而为临床治疗和诊断及评估预后的理论依据。
参考文献
[1] Rita Alaggio, Catalina Amador, Ioannis Anagnostopoulos, Ayoma D. Attygalle, Iguaracyra Barreto de Oliveira Araujo, Emilio Berti, Govind Bhagat, Anita Maria Borges, Daniel Boyer, Mariarita Calaminici, Amy Chadburn, John K. C. Chan, Wah Cheuk, Wee-Joo Chng, John K. Choi, Shih-Sung Chuang, Sarah E. Coupland, Magdalena Czader, Sandeep S. Dave, Daphne de Jong, Ming-Qing Du, Kojo S. Elenitoba-Johnson, Judith Ferry, Julia Geyer, Dita Gratzinger, Joan Guitart, Sumeet Gujral, Marian Harris, Christine J. Harrison, Sylvia Hartmann, Andreas Hochhaus, Patty M. Jansen, Kennosuke Karube, Werner Kempf, Joseph Khoury, Hiroshi Kimura, Wolfram Klapper, Alexandra E. Kovach, Shaji Kumar, Alexander J. Lazar,Stefano Lazzi, Lorenzo Leoncini, Nelson Leung, Vasiliki Leventaki, Xiao-Qiu Li, Megan S. Lim,Wei-Ping Liu, Abner Louissaint Jr, Andrea Marcogliese, L. Jeffrey Medeiros, Michael Michal,Roberto N. Miranda, Christina Mitteldorf, Santiago Montes-Moreno, William Morice, Valentina Nardi,Kikkeri N. Naresh, Yasodha Natkunam, Siok-Bian Ng, Ilske Oschlies, German Ott, Marie Parrens,Melissa Pulitzer, S. Vincent Rajkumar, Andrew C. Rawstron, Karen Rech, Andreas Rosenwald, Jonathan Said,Clémentine Sarkozy, Shahin Sayed, Caner Saygin, Anna Schuh, William Sewell, Reiner Siebert,Aliyah R. Sohani, Reuben Tooze, Alexandra Traverse-Glehen, Francisco Vega, Beatrice Vergier,Ashutosh D. Wechalekar, Brent Wood, Luc Xerri and Wenbin Xiao. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022 Jul;36(7):1720-1748.
[2] Suheil Albert Atallah-Yunes, Michael J. Robertson, Utpal P. Davé. Epigenetic Aberrations and Targets in Peripheral T-Cell Lymphoma. Clin Lymphoma Myeloma Leuk. 2022 Sep;22(9):659-665.
[3] Stefano A Pileri, Valentina Tabanelli, Stefano Fiori, Angelica Calleri, Federica Melle, Giovanna Motta, Daniele Lorenzini, Corrado Tarella, Enrico Derenzini.Peripheral T-Cell Lymphoma, Not Otherwise Specified: Clinical Manifestations, Diagnosis, and Future Treatment. Cancers (Basel). 2021 Sep 9;13(18):4535.
[4] Shigeru Chiba, Mamiko Sakata-Yanagimoto, Advances in understanding of angioimmunoblastic T-cell lymphoma. Leukemia. 2020 Oct;34(10):2592-2606.
[5] Tayla B Heavican, Alyssa Bouska, Jiayu Yu, Waseem Lone, Catalina Amador, Qiang Gong, Weiwei Zhang, Yuping Li, Bhavana J Dave, Maarja-Liisa Nairismägi, Timothy C Greiner, Julie Vose, Dennis D Weisenburger, Cynthia Lachel, Chao Wang, Kai Fu, Jadd M Stevens, Soon Thye Lim, Choon Kiat Ong, Randy D Gascoyne, Edoardo Missiaglia, Francois Lemonnier, Corinne Haioun, Sylvia Hartmann, Martin Bjerregård Pedersen, Maria Antonella Laginestra, Ryan A Wilcox, Bin Tean Teh, Noriaki Yoshida, Koichi Ohshima, Masao Seto, Andreas Rosenwald, German Ott, Elias Campo, Lisa M Rimsza, Elaine S Jaffe, Rita M Braziel, Francesco d'Amore, Giorgio Inghirami, Francesco Bertoni, Laurence de Leval, Philippe Gaulard, Louis M Staudt, Timothy W McKeithan, Stefano Pileri, Wing C Chan, Javeed Iqbal. Genetic drivers of oncogenic pathways in molecular subgroups of peripheral T-cell lymphoma. Blood. 2019 Apr 11;133(15):1664-1676.
[6] Zhang XR, Chien PN, Nam SY, Heo CY.Anaplastic Large Cell Lymphoma: Molecular Pathogenesis and Treatment. Cancers (Basel). 2022 Mar 24;14(7):1650.
[7] Myunggon Ko 1, Hozefa S Bandukwala, Jungeun An, Edward D Lamperti, Elizabeth C Thompson, Ryan Hastie, Angeliki Tsangaratou, Klaus Rajewsky, Sergei B Koralov, Anjana Rao. Ten-Eleven-Translocation 2 (TET2) negatively regulates homeostasis and differentiation of hematopoietic stem cells in mice. Proc Natl Acad Sci U S A. 2011 Aug 30;108(35):14566-71.
[8] Odejide O, Weigert O, Lane AA, Toscano D, Lunning MA, Kopp N, Kim S, van Bodegom D, Bolla S, Schatz JH, Teruya-Feldstein J, Hochberg E, Louissaint A, Dorfman D, Stevenson K, Rodig SJ, Piccaluga PP, Jacobsen E, Pileri SA, Harris NL, Ferrero S, Inghirami G, Horwitz SM, Weinstock DM. A targeted mutational landscape of angioimmunoblastic T-cell l ymphoma. Blood. 2014 Feb 27;123(9):1293-6.
[9] Kubuki Y, Yamaji T, Hidaka T, Kameda T, Shide K, Sekine M, Kamiunten A, Akizuki K, Shimoda H, Tahira Y, Nakamura K, Abe H, Miike T, Iwakiri H, Tahara Y, Sueta M, Yamamoto S, Hasuike S, Nagata K, Kitanaka A, Shimoda K.TET2 mutation in diffuse large B-cell lymphoma. J Clin Exp Hematop. 2017;56(3):145-149.
[10] Yang L, Rodriguez B, Mayle A, Park HJ, Lin X, Luo M, Jeong M, Curry CV, Kim SB, Ruau D, Zhang X, Zhou T, Zhou M, Rebel VI, Challen GA, Gottgens B, Lee JS, Rau R, Li W, Goodell MA. DNMT3A loss drives enhancer hypomethylation in FLT3-ITD-associated leukemias. Cancer Cell. 2016 Jun 13;29(6):922-934.
[11] Liran I Shlush, Sasan Zandi, Amanda Mitchell, Weihsu Claire Chen, Joseph M Brandwein, Vikas Gupta, James A Kennedy, Aaron D Schimmer, Andre C Schuh, Karen W Yee, Jessica L McLeod, Monica Doedens, Jessie J F Medeiros, Rene Marke, Hyeoung Joon Kim, Kwon Lee, John D McPherson, Thomas J Hudson; HALT Pan-Leukemia Gene Panel Consortium; Andrew M K Brown, Fouad Yousif, Quang M Trinh, Lincoln D Stein, Mark D Minden, Jean C Y Wang, John E Dick. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature. 2014 Feb 20;506(7488):328-33.
[12] Staci L Haney, G Michael Upchurch, Jana Opavska, David Klinkebiel, Ryan A Hlady, Sohini Roy, Samikshan Dutta, Kaustubh Datta, Rene Opavsky. Dnmt3a is a haploinsufficient tumor suppressor in CD8+ peripheral T cell lymphoma. PLoS Genet. 2016 Sep 30;12(9):e1006334.
[13] Qiong Li, Chunhua Tang, Jie Zhu, Lili Zhang.A case of progressive multifocal leukoencephalopathy with hypogammaglobulinemia and a TCF3 mutation. J Neurovirol. 2022 Dec;28(4-6):616-618.
[14] Ae Kyung Park, Pora Kim, Leomar Y Ballester, Yoshua Esquenazi, Zhongming Zhao. Subtype-specific signaling pathways and genomic aberrations associated with prognosis of glioblastoma. Neuro Oncol. 2019, Jan 1;21(1):59-70.
[15] Timmins MA, Wagner SD, Ahearne MJ. The new biology of PTCL-NOS and AITL: current status and future clinical impact. Br J Haematol. 2020 Apr;189(1):54-66.
[16] Wang J, Tang W, Zhang W, Wang J, Chen F, Zhong L, Chen Y, Chen G. Clinicopathological characterization of follicular helper T-cell-derived peripheral T-cell lymphoma involving Waldeyer's ring. Virchows Arch. 2021 Aug 479(2):355-363.
[17] Fan J, Bellon M, Ju M, Zhao L, Wei M, Fu L, Nicot C. Clinical significance of FBXW7 loss of function in human cancers. Mol Cancer. 2022 Mar 26;21(1):87.
[18] Hu L, Zhang X, Li H, Lin S, Zang S. Targeting TET2 as a Therapeutic Approach for Angioimmunoblastic T Cell Lymphoma. Cancers (Basel). 2022 Nov 20;14(22):5699.
[19] Arisi MF, Dotan E, Fernandez SV. Circulating Tumor DNA in Precision Oncology and Its Applications in Colorectal Cancer. Int J Mol Sci. 2022 Apr 18;23(8):4441.
[20] Haiying Fu, Huarong Zhou, Yanyan Qiu, Jianfei Wang, Zhiming Ma, Hongping Li, Feng Zhang, Chenxi Qiu, Jianzhen Shen, Tingbo Liu. SEPT6_TRIM33 Gene Fusion and Mutated TP53 Pathway Associate With Unfavorable Prognosis in Patients With B-Cell Lymphomas. Front Oncol. 2021 Dec 1,11: 765544.
[21] Soerensen JF, Aggerholm A, Rosenberg CA, Bill M, Kerndrup GB, Ebbesen LH, Hansen MH, Roug AS, Ludvigsen M. Clonal evolution in patients developing therapy-related myeloid neoplasms following autologous stem cell transplantation. Bone Marrow Transplant. 2022 Mar;57(3):460-465.