葡萄糖基修饰的还原响应双氢青蒿素微粒有利于增加药物在疟原虫体内的富集、实现更好的抗疟药效
疟疾是一种严重威胁人类健康的虫媒传染病,双氢青蒿素(DHA)对疟疾有很强的治疗作用。然而,由于DHA的半衰期短,导致只有一小部分药物能够进入寄生虫,发挥抗疟疗效。
疟原虫为了维持自身快速生长繁殖的能量需要,通过增加宿主细胞膜上葡萄糖转运蛋白1(GLUT1)的表达和在寄生虫膜上表达己糖转运蛋白(HT),使大量葡萄糖由血浆主动转运至寄生虫中。同时疟原虫会通过向宿主细胞外排氧化型谷胱甘肽、合成还原型谷胱甘肽的方式保护寄生虫免受氧化应激损伤。
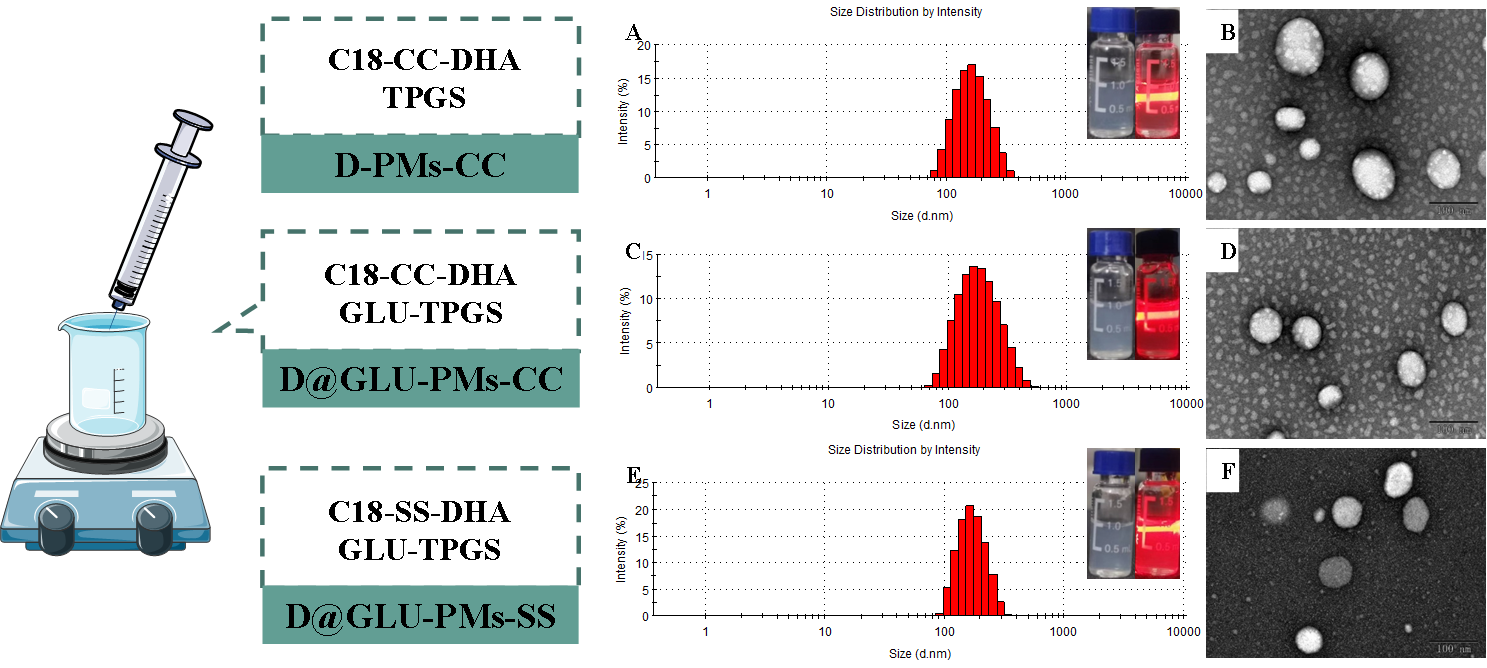
图1 D-PMs-CC(A、B)、D@GLU-PMs-CC(C、D)和D@GLU-PMs-SS(E、F)的粒径分布、透射电镜及外观图
为了将更多的药物被转运至疟原虫内,在本研究中,以二硫键为连接臂的双氢青蒿素-十八胺偶联化合物为基础,加入葡萄糖修饰的TPGS-GLU作为稳定剂,采用纳米沉淀法制备了无葡萄糖基修饰的非还原响应微粒(D-PMs-CC)、葡萄糖基修饰的非还原响应微粒(D@GLU-PMs-CC)和葡萄糖基修饰的还原响应微粒(D@GLU-PMs-SS)(图1)。
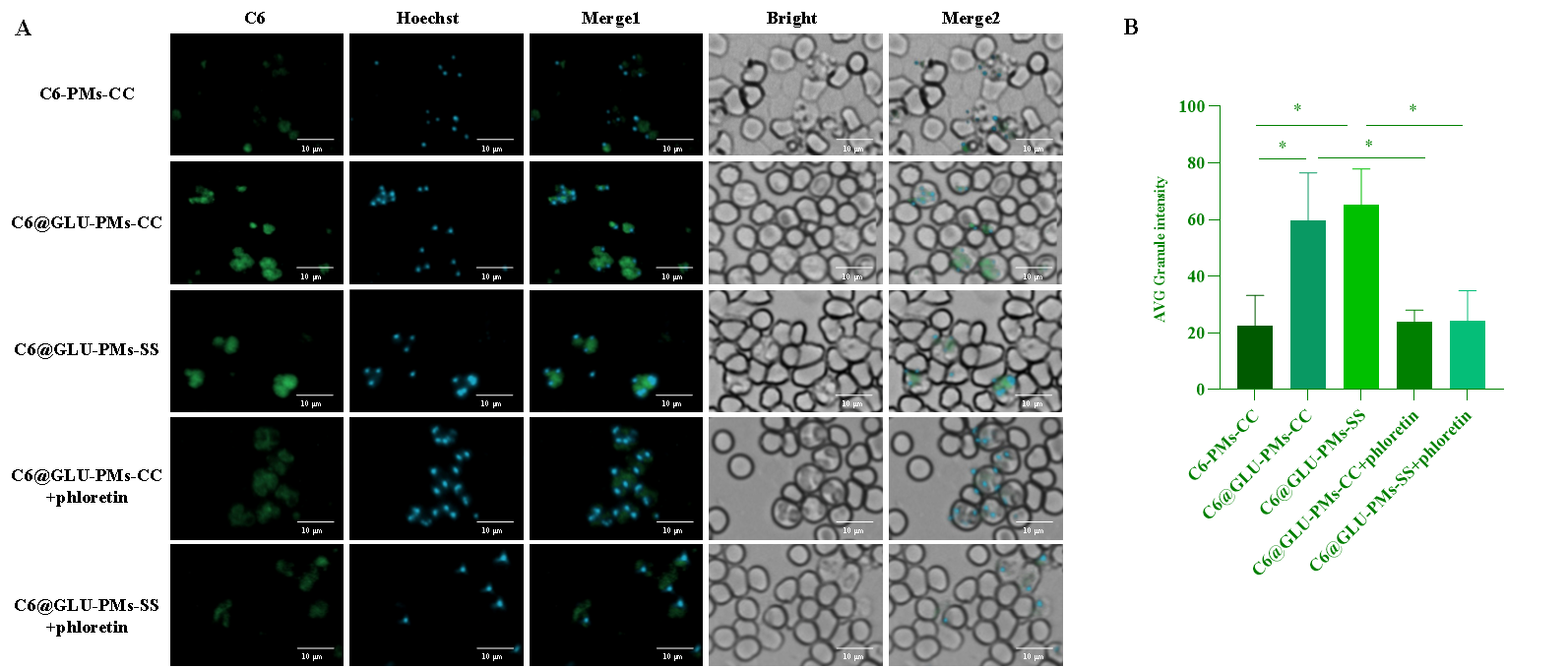
图2 C6-PMs-CC、C6@GLU-PMs-CC和C6@GLU-PMs-SS的体外靶向性(A、B)和红细胞内靶向性(C)评价(n = 3)
以香豆素6(C6)标记的无葡萄糖基修饰的非还原响应微粒(C6-PMs-CC)为对照,微粒与感染的红细胞共孵育后,葡萄糖基修饰微粒在疟原虫中的富集显著增强(P<0.05)(图2)。
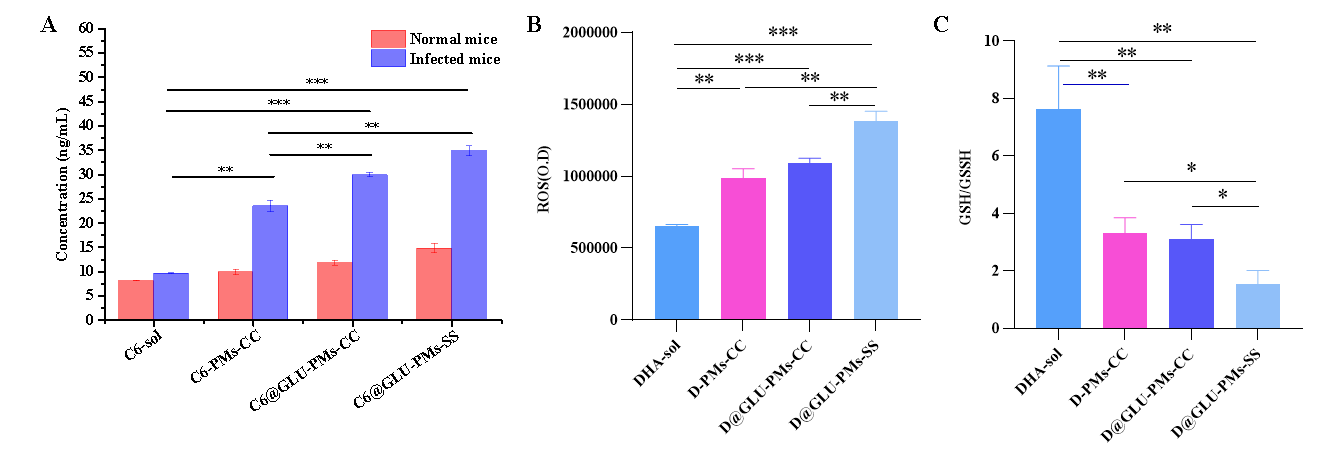
图3 C6-PMs-CC、C6@GLU-PMs-CC和C6@GLU-PMs-SS的红细胞内靶向性(A)评价;DHA-sol、D-PMs-CC、D@GLU-PMs-CC和D@GLU-PMs-SS作用后红细胞内的ROS(B)和疟原虫内的GSH/GSSG比值(C)的测定(n = 3)
将C6标记的微粒注射到疟原虫感染的小鼠体内,C6@GLU-PMs-CC组感染小鼠红细胞中的C6含量(11.81 ng/ml ± 0.54 ng/ml)明显高于 C6-PMs-CC 组(9.97 ng/ml ± 0.50 ng/ml)(P<0.05)(图3A)。将微粒与受感染的红细胞在体外进行共孵育,D@GLU-PMs-SS组中红细胞中的ROS和疟原虫中的GSH/GSSG比值分别是D@GLU-PMs-CC对照组的1.27倍和0.49倍(图3AB)。
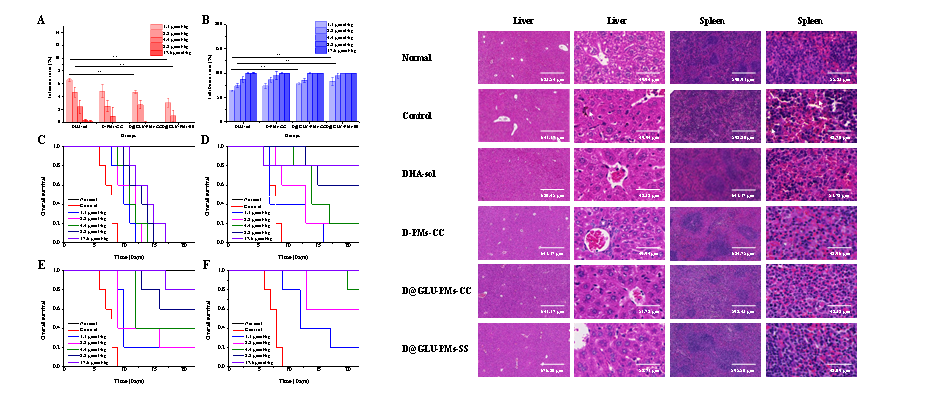
图4 DHA-sol、D-PMs-CC、D@GLU-PMs-CC和D@GLU-PMs-SS停药1天的感染率(A)、抑制率(B)、存活情况(C:DHA-sol,D:D-PMs-CC,E:D@GLU-PMs-CC,F:D@GLU-PMs-SS)和治疗后小鼠的肝、脾H&E染色(**P < 0.01,n = 5)
与DHA溶液、D-PMs-CC组或D@GLU-PMs-CC组相比,D@GLU-PMs-SS组具有更优的抗疟活性和安全性(P<0.05)。
综上所述,本研究揭示对双氢青蒿素微粒进行葡萄糖基和还原响应修饰,可实现微粒在疟原虫体内的富集,达到更好的抗疟效果,为今后抗疟药递送系统的设计提供新策略。
山西医科大学药学院王蓉蓉为本文第一作者,山西医科大学药学院张淑秋教授为本文通信作者。本项目得到国家自然科学基金面上项目的支持。