不同程度骨骼肌损伤后的转录动力学特征研究
目前,我们对肌肉损伤修复过程的认识大部分是从肌肉疾病和与致病过程相关的肌肉损伤研究中获得的,如杜氏肌营养不良和缺血性损伤。然而,在慢性肌肉疾病中,其在病理进程可持续数十年,包括反复的损伤、炎症、修复和再生尽管肌肉对慢性损伤反应的许多机制与急性损伤后介导修复和再生的机制相似,但这种反复损伤进而导致结缔组织过度堆积,对肌肉功能有长期影响。手术中骨骼肌缺血性损伤主要是有骨骼肌血流和供氧不足引起的,这些修复过程与骨骼肌机械性损伤修复机制存在不同。
因此,有必要对机械性损伤后的骨骼肌修复过程中的复杂的多分子动态生物学变化规律和信息进行解码, 发掘参与再生修复的关键调控因子及通路, 加深我们对骨骼肌损伤-修复-再生过程的认识,为骨骼肌修复再生机制的研究奠定基础。
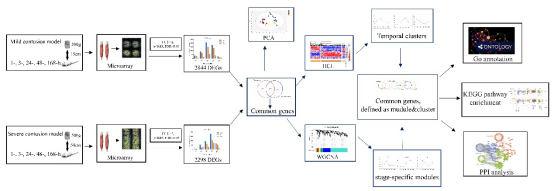
图1 实验及分析流程
在轻度和重度挫伤组中共表达1620个基因的PCA结果再次显示,尽管骨骼肌损伤后转录谱在不同损伤程度存在差异,但在轻度与重度共表达基因的变化中损伤程度并不是主要影响因素,而这些基因表达与损伤时间关系更为密切。此外,层次聚类(HCL)及WGCNA分析结果(图2、图3)再次显示1620 个共表达基因在损伤后 48h 内表现出明显的时间依赖性变化,表明不同程度骨骼肌损伤后存在共同的修复调控机制。
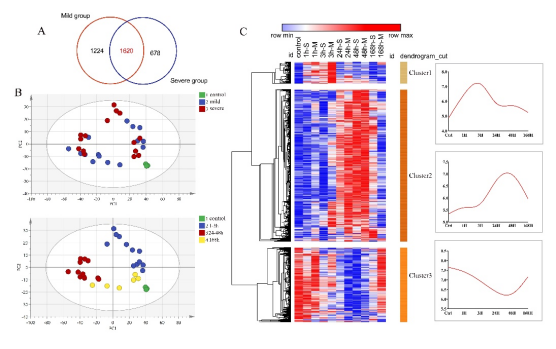
图2 两挫伤组共表达基因主成分分析和层次聚类分析
注: A 轻度和重度挫伤组间DEGs的Venn图;B轻度和重度挫伤组1620个共有基因的PCA结果;C所有DEGs基于层次聚类的热图(左:-M和-S分别表示轻度和重度损伤),以及每个基因簇根据伤口年龄的平均表达(右)
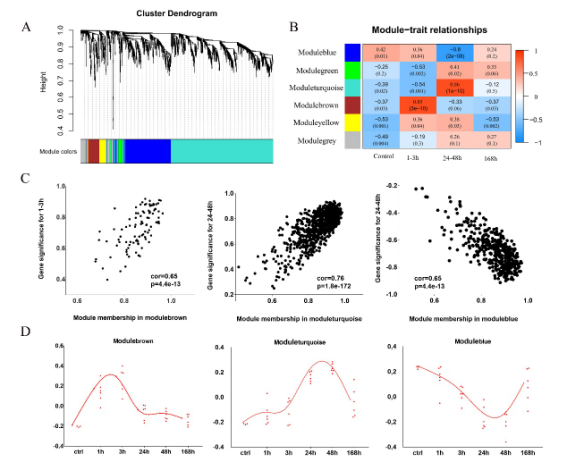
图3 加权基因共表达网路WGCNA分析
注:A 基因模块的聚类树状图;B 每个Cluster中基因表达量随损伤时间的变化
C 不同模块的GS和MM的相关性;Cor:相关系数;D不同模块中基因的表达变化趋势
有趣的是,我们发现在骨骼肌损伤后 24-48h 许多下调基因与线粒体及代谢途径有关,其中OXPHOS通路下调最为显著, OXPHOS通路中的基因主要编码线粒体氧化呼吸链中复合体 I– V。呼吸链复合体作为电子载体在线粒体膜两侧可产生质子梯度,从而驱动三磷酸腺苷(ATP) 的合成(图4A)。这些基因下调将会大导致复合物 I– V 的活性降低, 但尤其是在 OXPHOS 通路中下调基因数目最多的复合物 I,可导致ATP合成受阻,从而产生大量活性氧。这可能与损伤后损伤 24-48h 炎症反应引起大量 ROS 产生以及线粒体损伤相关。
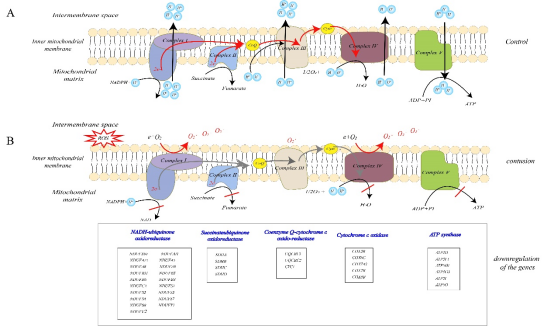
图4 线粒体氧化呼吸链及活性氧产生部位
注:A 对照组中线粒体氧化呼吸复合体的结构图;B 氧化呼吸复合体 I-V 活性降低后 ROS 的产生部位,以及微阵列数据中与复合体相对应的下调基因列表
此部分内容已于2021年1月5日发表在bioscience reports上。