我校曹济民教授团队在《Chemical Engineering Journal》发文:半人工细菌焦亡诱导剂用于逆转肿瘤微环境的代谢重编程
稿件来源:基础医学院 发布时间:2025-03-20 点击次数:
3月15日,细胞生理学教育部重点实验室曹济民教授团队在国际权威期刊《Chemical Engineering Journal》(中国科学院一区TOP期刊,影响因子13.3)发表题为《Semi-artificial bacterial pyroptosiser for reverse the metabolic reprogramming of tumor microenvironment》的合作研究成果。我校王德平教授为共同第一作者,我校曹济民教授、天津医科大学郑斌教授及阮先辉教授为共同通讯作者,我校周鑫教授和硕士生郝英健为共同作者。
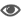
肿瘤微环境中,肿瘤细胞与免疫细胞间的营养竞争异常激烈,肿瘤细胞通过代谢重编程掠夺葡萄糖资源,导致免疫细胞能量供给受限,严重削弱其抗肿瘤活性。此外,传统光热疗法虽可杀伤肿瘤,但肿瘤细胞可通过有效的营养摄取来上调热休克蛋白(HSPs)的表达,从而对热应激产生耐受性,降低光热治疗的敏感性。因此,研究团队创新性设计了一种半人工细菌焦亡诱导剂(SBP),用于逆转肿瘤微环境的代谢重编程。这种SBP基于硫化铜(CuS)和细菌细胞壁主要成分脂多糖(LPS)构建,通过仿生矿化获得具有类细菌免疫刺激特性与光热消融功能的纳米颗粒(LPS@CuS SBP),实现代谢干预与免疫激活的双重功能。

LPS@CuS SBP的制备流程及光热-免疫协同作用机制示意图
细胞与动物水平的机制研究表明,LPS@CuS SBP可显著增强巨噬细胞活性,增强其与肿瘤细胞的葡萄糖竞争,从而降低肿瘤细胞内ATP生成及热休克蛋白(HSPs)表达,抑制肿瘤细胞在热刺激下的自我修复能力,从而为光热治疗创造理想微环境。同时,LPS@CuS SBP可诱导肿瘤细胞发生非经典焦亡,释放白细胞介素-6(IL-6)、IL-18等促炎因子,并激活抗原呈递细胞(APCs),促使其在肿瘤区域富集。在近红外(NIR)激光照射下,LPS@CuS SBP通过光热效应杀伤肿瘤细胞,触发肿瘤抗原及肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6等细胞因子的释放。上述释放因子与焦亡产生的细胞碎片协同介导APCs的成熟活化,使其能够高效呈递抗原至CD8+ T细胞。最终,活化的CD8+ T细胞显著增强肿瘤杀伤效能,实现肿瘤的清除。该成果为逆转肿瘤免疫抑制微环境提供了创新解决方案,随着进一步优化,LPS@CuS SBP有望成为高效、低毒的肿瘤免疫治疗候选方案,助力精准医学发展。
(图文/王德平)
复审复校:王卓
终审终校:侯小宝
发布:倪彦佩