我校曹济民团队与北京航空航天大学曹芳芳团队联合构建智能响应型CuFeTe2纳米片增强三阴性乳腺癌铜死亡与铁死亡治疗效应
稿件来源:基础医学院 发布时间:2025-10-27 点击次数:
2025年10月24日,我校细胞生理学教育部重点实验室曹济民教授团队与北京航空航天大学曹芳芳(国家级高层次青年人才)团队在国际高水平期刊《Advanced Science》(中国科学院一区TOP期刊,IF=14.1)在线发表了题为“Stimuli-responsive CuFeTe2 Nanosheets for Amplified Cuproptosis/Ferroptosis in Triple-Negative Breast Cancer Therapy”的研究论文(DOI: 10.1002/advs.202505739)。我校研究生刘墨琳、郑健以及北京航空航天大学研究生于梦琦为本文的共同第一作者,我校曹济民教授、冯艳林教授,北京航空航天大学曹芳芳教授以及中国人民解放军总医院刘熹助理研究员为本文的通讯作者。
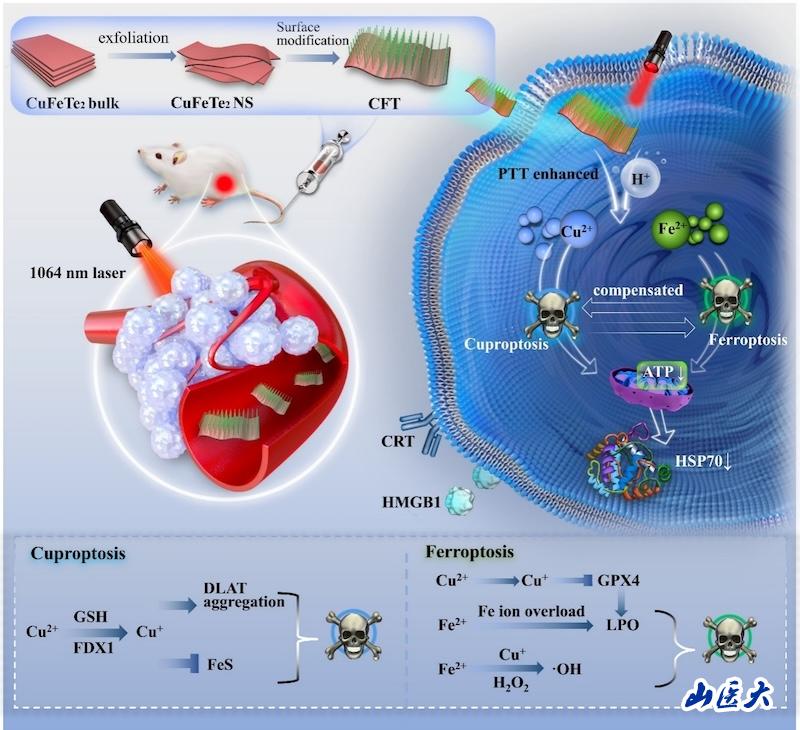
该研究创新性地构建了一种肿瘤微环境响应与光热增强双调控的CuFeTe2纳米平台(CFT),通过协同诱导铜死亡(cuproptosis)与铁死亡(ferroptosis),显著放大肿瘤细胞氧化应激反应并激活抗肿瘤免疫,为三阴性乳腺癌(TNBC)治疗提供了全新的纳米医学策略。
三阴性乳腺癌因缺乏雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER2)表达而无法应用内分泌或靶向治疗,临床上具有侵袭性强、转移率高、缺乏有效疗法、预后差等特点。该研究发现,TNBC细胞中铜与铁的代谢活性显著升高,对金属离子依赖性细胞死亡更为敏感。基于此,研究团队设计了兼具肿瘤微环境(TME)响应性与近红外二区(NIR-II)光热调控特性的CuFeTe2纳米片,实现了对TNBC细胞铜死亡与铁死亡的双通道精准放大。
CFT纳米片在肿瘤酸性微环境中逐步降解释放Fe2+与Cu2+,其中Cu2+在谷胱甘肽(GSH)与线粒体氧化还原酶FDX1作用下转化为Cu+,引发二氢硫辛酰胺S-乙酰转移酶(DLAT)聚集和铁硫簇蛋白破坏,触发铜死亡;同时,GSH的消耗削弱了细胞抗氧化防御,抑制GPX4活性,促进脂质过氧化积累并诱导铁死亡,而Fe2+积累也可促进脂质过氧化(LPO)和铁死亡。Cu+与Fe²⁺还可协同催化过氧化氢(H₂O₂)生成羟基自由基(•OH),提高活性氧自由基(ROS)水平,加剧肿瘤的氧化应激反应。
CFT在NIR-II光照下产生的温和光热效应可进一步促进催化反应速率和ATP耗竭,削弱肿瘤抗氧化防御,显著增强肿瘤细胞铜死亡与铁死亡的协同效应。此外,铁死亡会耗尽热休克蛋白70(HSP70)并降低ATP水平,使肿瘤细胞对铜死亡更敏感,最终诱导免疫原性细胞死亡(ICD),激活树突状细胞成熟和T细胞免疫反应,从而形成系统性抗肿瘤免疫效果。动物毒理实验表明,CFT具有良好的生物相容性,可在降解后经肾脏高效清除。
该研究提出了一种“内源TME响应+外源光热调控”双刺激自放大策略,实现了铜-铁协同诱导的氧化应激放大与免疫激活,为TNBC等难治性肿瘤的治疗提供了新思路。
本研究受到国家自然科学基金、山西省自然科学基金、山西省高等教育“百亿工程”科技引导专项、中国科协青年人才托举工程及北京市自然科学基金资助。
(文/冯艳林)
复审复校:王卓
终审终校:侯小宝
发布:倪彦佩