食管鳞状细胞癌 (ESCC) 是最具侵袭性的鳞状细胞癌之一,在亚洲非常流行。ESCC的发病率受环境因素(饮酒、吸烟等)和遗传因素的影响,两者都通过改变食管上皮细胞的蛋白质组学、翻译后修饰 (PTM) 和代谢特征导致肿瘤发生。最近,已经对 ESCC 进行了大规模调查,重点是发现新的驱动突变。然而,ESCC 发展的潜在机制尚不清楚,需要对 ESCC 进行全面的蛋白质分析以了解其潜在机制。
2021年11月12日,中国医学科学院/北京协和医学院刘芝华及山西医科大学崔永萍共同通讯在Signal Transduction and Targeted Therapy(IF=18.19)在线发表题为“Phosphoproteomics reveals therapeutic targets of esophageal squamous cell carcinoma”的研究论文,该研究从 94 例中晚期(TNM II-IV 期)ESCC 中选择了 94 个手术切除的原发肿瘤组织 (T) 和 24 个非肿瘤食管组织 (N),并进行了广泛的蛋白质组学和磷酸蛋白质组学表征。
该研究总共鉴定了 9,042 个蛋白质以及 26,892 个磷酸位点。蛋白质组学数据共鉴定了 556 种差异表达蛋白(DEP),包括 227 种上调和 329 种下调蛋白。ESCC的主要特征是剪接体途径和细胞周期途径中蛋白质组学和磷酸蛋白质组学水平升高,并降低ECM-受体相互作用和粘着斑途径。此外,该研究定义了该 ESCC 肿瘤队列中的三种主要蛋白质组亚型(S-I、S-II 和 S-III),并且S-III具有显著最低的无病生存期(DFS)和最大比例的淋巴结转移患者,并且其特征在于剪接体途径中的蛋白质和磷酸化蛋白水平升高。
总之,该研究数据显示手术后预后最差的 S-III ESCC 的特征是剪接体途径中蛋白质组和磷酸蛋白质组水平升高,一些作为 CLK1 激酶增强剂的 PP1 抑制剂(CD2BP2、WBP11 等)在 S-III 中被上调并参与 ESCC 的发展;CLK1可能代表一个新的有希望的治疗靶点,试图改善 ESCC 的不良预后。

食管鳞状细胞癌 (ESCC) 是最具侵袭性的鳞状细胞癌之一,在亚洲非常流行。ESCC的发病率受环境因素(饮酒、吸烟等)和遗传因素的影响,两者都通过改变食管上皮细胞的蛋白质组学、翻译后修饰 (PTM) 和代谢特征导致肿瘤发生。最近,已经对 ESCC 进行了大规模调查,重点是发现新的驱动突变。然而,ESCC 发展的潜在机制尚不清楚,需要对 ESCC 进行全面的蛋白质分析以了解其潜在机制。迄今为止,ESCC患者的治疗方法主要包括内镜治疗、手术治疗和放化疗。然而,大多数患者尤其是预后较差的ESCC患者仍缺乏有效的靶向治疗。磷酸化在细胞中很常见,并导致对细胞很重要的下游信号事件的级联,并且该过程的失调与癌症有关。到目前为止,在开发拮抗在癌症中异常激活的激酶活性的治疗药物方面已经取得了很大进展。磷酸化蛋白质组学的实施可以为开发有效的治疗靶点提供更多线索,这是理所当然的。该研究从 94 例中晚期(TNM II-IV 期)ESCC 中选择了 94 个手术切除的原发肿瘤组织 (T) 和 24 个非肿瘤食管组织 (N),并进行了广泛的蛋白质组学和磷酸蛋白质组学表征。使用 iTRAQ 技术进行一致的质量控制。总共鉴定了 9,042 个蛋白质以及 26,892 个磷酸位点。蛋白质组学数据共鉴定了 556 种差异表达蛋白(DEP),包括 227 种上调和 329 种下调蛋白。
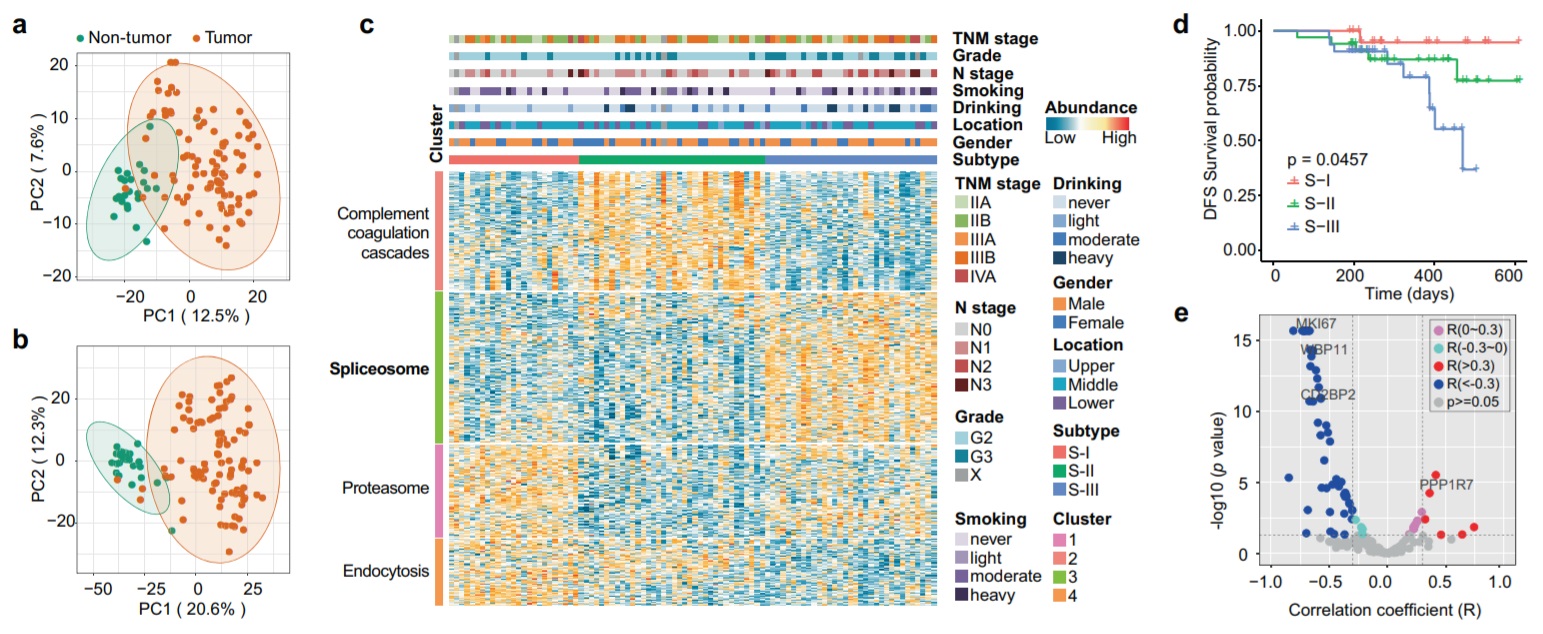
ESCC的主要特征是剪接体途径和细胞周期途径中蛋白质组学和磷酸蛋白质组学水平升高,并降低ECM-受体相互作用和粘着斑途径。 此外,该研究定义了该 ESCC 肿瘤队列中的三种主要蛋白质组亚型(S-I、S-II 和 S-III)。并且S-III具有显著最低的无病生存期(DFS)和最大比例的淋巴结转移患者,并且其特征在于剪接体途径中的蛋白质和磷酸化蛋白水平升高。为了识别过度活跃的激酶并探索 ESCC 中的药物靶点,激酶活性预测来自磷酸肽数据。与高水平的细胞周期活性一致,ESCC 肿瘤组织(尤其是 S-III)中的核定位 S/T 激酶(CDK)(簇 2)活性高于非肿瘤组织。该研究将磷酸酶和磷酸酶相互作用蛋白 (PIP)(也称为调节亚基)一起视为一种单位酶,用于通过磷酸酶或磷酸酶-PIP 底物富集分析 (PhSEA) 预测其活性。为了进一步了解它们在肿瘤发展中的功能作用,产生了与差异表达的磷酸化相互作用物(DEPI)相关的 PPP1C-PIP 的 KEGG 通路,并且顶部通路富含 PPP1C-CD2BP2 和 PPP1C 的 DEPI -WBP11 ,这两者都是剪接体途径。磷酸酶与相应的激酶很好地协调以确保蛋白质的磷酸化稳态。通过配对关系分析 (PRA) 分析了每种磷酸酶的相应激酶。数据表明,在 ESCC S-III 中 SRSF 家族蛋白和 HNRNPD 磷酸化上调。S-III患者手术后预后最差,应进一步接受靶向治疗。为了评估 CLK1 对进一步 ESCC 治疗的潜力,使用了 TG003(CLK1 抑制剂)并将其腹膜内注射到三个 ESCC 患者来源的肿瘤异种移植(PDX)小鼠模型中。用中等剂量的 TG003 治疗对小鼠体重没有影响,并且在两种 PDX 模型中降低了肿瘤生长。然而,中等剂量的 TG003 对 PDX#3 中的肿瘤生长没有影响,只有高剂量的 TG003 对减少肿瘤生长有影响。此外,与 CDK4/6 抑制剂(palbocicib)相比,TG003 在治疗具有高水平 CD2BP2 和 WBP11 的 ESCC 方面更具优势。总体而言,该研究数据显示手术后预后最差的 S-III ESCC 的特征是剪接体途径中蛋白质组和磷酸蛋白质组水平升高,一些作为 CLK1 激酶增强剂的 PP1 抑制剂(CD2BP2、WBP11 等)在 S-III 中被上调并参与 ESCC 的发展;CLK1 可能代表一个新的有希望的治疗靶点,试图改善 ESCC 的不良预后。
(来源/枫叶 iNature. STTT | 山西医科大学等多单位合作,刘芝华/崔永萍使用磷酸化蛋白质组学揭示食管鳞状细胞癌的治疗靶点2021-11-14)
